题目内容
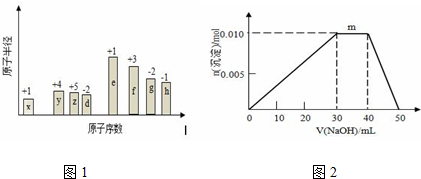
2. 已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.①写出下列物质的化学式:CNaOH,ENaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
分析 F是引起酸雨的主要气体,则F为SO2,A与F反应生成硫酸钠,A为淡黄色固体,可知A为Na2O2,B是常见液体,D是两性氧化物,结合转化可知,B为水,C为NaOH,D为Al2O3,E为NaAlO2,以此来解答.
解答 解:F是引起酸雨的主要气体,则F为SO2,A与F反应生成硫酸钠,A为淡黄色固体,可知A为Na2O2,B是常见液体,D是两性氧化物,结合转化可知,B为水,C为NaOH,D为Al2O3,E为NaAlO2,
①由上述分析可知,C为NaOH,E为NaAlO2,故答案为:NaOH;NaAlO2;
②A与F反应的化学方程式为Na2O2+SO2=Na2SO4,故答案为:Na2O2+SO2=Na2SO4.
点评 本题考查无机物的推断,为高频考点,把握酸雨、淡黄色固体为推断的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
13. 如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )
如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )
 如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )
如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )| A. | >2 | B. | <2 | C. | =2 | D. | 1~2之间 |
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(OH-)=0.1mol/L的溶液:Na+、K+、CO32-、ClO- | |
| B. | 滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 含有Fe3+的溶液中:Na+、Al3+、Cl-、SCN- | |
| D. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ |
17. 屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
 屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )| A. | 分子式为C15H24O2 | B. | 属子芳香族化合物 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有原子可能共平面 |
7.下列各组离子在溶液中能大量共存的是( )
| A. | Na+、OH-、S2O${\;}_{3}^{2-}$、Cl- | B. | Fe2+、K+、H+、NO${\;}_{3}^{-}$ | ||
| C. | H+、C2O${\;}_{4}^{2-}$、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | D. | Na+、Ca2+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ |
17.下列对可逆反应的认识正确的是( )
| A. | SO2+Br2+2H2OH2SO4+2HBr与2HBr+H2SO4(浓) Br2+SO2↑+2H2O互为可逆反应 | |
| B. | 既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 | |
| C. | 在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 | |
| D. | 在一定条件下,SO2被氧化成SO3的反应是可逆反应 |
 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示: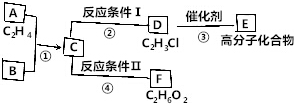 已知:
已知: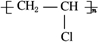 ,FCH2OHCH2OH.
,FCH2OHCH2OH.