题目内容
5.室温下,由水电离出的 c(H+)=10-11mol/L 溶液中,一定能大量存在的离子是( )| A. | Fe3+ | B. | CH3COO- | C. | HCO3- | D. | NO3- |
分析 某溶液中由水电离的c(OH-)为1.0×10-11mol•L-1,说明水的电离受到抑制,溶液可能为酸溶液,也可能为碱溶液,离子能大量共存,则离子之间不发生任何反应,以此解答该题.
解答 解:A.Fe3+在碱溶液中析出沉淀,不能大量共存,故A错误;
B.CH3COO-在酸溶液中不能大量共存,故B错误;
C.HCO3-酸碱溶液中都不能大量共存,故C错误;
D,NO3-离子酸碱中不反应能大量共存,故D正确;
故选D.
点评 本题考查离子共存问题,侧重于学生的分析能力的考查,为高考常见题型,注意把握题给信息,明确常见离子的性质以及反应类型为解答该题的关键,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
15.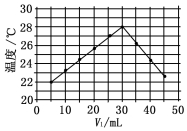 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
16.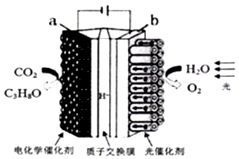 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O | |
| C. | 该装置工作时,H+从b极区向a极区迁移 | |
| D. | 每生成1molO2有44gCO2被还原 |
13.化学与生产和生活密切相关,下列有关说法正确的是( )
| A. | 硅太阳能电池利用的是原电池原理 | |
| B. | 用干燥的钢瓶盛装液氯和用铁制容器盛装容器盛装浓硝酸的原理相同 | |
| C. | 含有活性炭的口罩可阻挡雾霾,其原理是利用活性炭的吸附作用 | |
| D. | 用菜籽油浸泡花椒制得花椒油后,用分液的方法将花椒油分离出来 |
20.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | 0.1molCl2与足量石灰乳反应,转移电子的数目为0.2NA | |
| C. | 室温下,l L pH=13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA | |
| D. | 标准状况下,2.24 LNO2和N2O4混合气体中含有氧原子数目为0.2NA |
10.下列醇不能由烃和水加成制得的是( )
| A. |  | B. |  | C. |  | D. |  |
17.下列方案能达到实验目的是( )
| A. | 用浓硫酸干燥NH3 | B. | 用乙醇萃取溴水中的溴单质 | ||
| C. | 用品红溶液鉴别SO2和CO2 | D. | 用焰色反应鉴别KCl和KOH |
16.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 30gC2H6中含有极性共价键的数目为6NA | |
| B. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| C. | 1mol氯气分别与铁和铝完全反应时转移的电子数均为3NA | |
| D. | 25℃,pH=7的NH4Cl和NH3•H2O的混合溶液中,含OH-的数目为10-7NA |