题目内容
20.NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | 0.1molCl2与足量石灰乳反应,转移电子的数目为0.2NA | |
| C. | 室温下,l L pH=13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA | |
| D. | 标准状况下,2.24 LNO2和N2O4混合气体中含有氧原子数目为0.2NA |
分析 A、CnH2n的最简式为CH2;
B、氯气和碱反应时,1mol氯气转移1mol电子;
C、pH=13的氢氧化钠溶液中,氢离子全部来自水的电离,且水电离出的氢氧根浓度和氢离子浓度相同;
D、NO2和N2O4中含有的氧原子的个数不同.
解答 解:A、CnH2n的最简式为CH2,故14gCnH2n中含有的CH2的物质的量为1mol,故含2NA条C-H 键,故A正确;
B、氯气和碱反应时,1mol氯气转移1mol电子,故0.1mol氯气转移0.1mol电子即0.1NA个,故B错误;
C、pH=13的氢氧化钠溶液中,氢离子全部来自水的电离,故水电离出的氢离子的浓度为10-13mol/L,即水电离出的氢离子的物质的量为10-13mol,而水电离出的氢氧根物质的量和氢离子的物质的量相同,故此溶液中水电离出的氢氧根的物质的量为10-13mol,个数为10-13NA,故C错误;
D、标准状况下,2.24 LNO2和N2O4混合气体的物质的量为1mol,而NO2和N2O4中含有的氧原子的个数不同,且两者的比例不明确,故1mol混合气体中含有的氧原子的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
11.下表所示实验,现象和结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向浓度均为0.lmol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
| C | 向某溶液中滴加足量盐酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中含有S2-和SO32- |
| D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+KSCN?Fe(SCN)3+3KCl平衡向逆反应方向移动 |
| A. | A | B. | B | C. | C | D. | D |
15.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
5.室温下,由水电离出的 c(H+)=10-11mol/L 溶液中,一定能大量存在的离子是( )
| A. | Fe3+ | B. | CH3COO- | C. | HCO3- | D. | NO3- |
12.下列化学用语表示正确的是( )
| A. | 乙醇的结构简式:C2H6O | |
| B. | 氯化氢的电子式: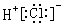 | |
| C. | 镁原子结构示意图: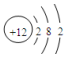 | |
| D. | 氢氧化钠的电离方程式:NaOH═Na++O2-+H+ |
11. 已知:CH3CH2CH2CH2OH$→_{90~95℃}^{Na_{2}Cr_{2}O_{7}/H+}$CH3CH2CH2CHO
已知:CH3CH2CH2CH2OH$→_{90~95℃}^{Na_{2}Cr_{2}O_{7}/H+}$CH3CH2CH2CHO
利用如图装置用正丁醇合成正丁醛.相关数据如表:
下列说法中,不正确的是( )
 已知:CH3CH2CH2CH2OH$→_{90~95℃}^{Na_{2}Cr_{2}O_{7}/H+}$CH3CH2CH2CHO
已知:CH3CH2CH2CH2OH$→_{90~95℃}^{Na_{2}Cr_{2}O_{7}/H+}$CH3CH2CH2CHO利用如图装置用正丁醇合成正丁醛.相关数据如表:
| 物质 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
| A. | 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中 | |
| B. | 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物 | |
| C. | 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出 | |
| D. | 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇 |