题目内容
17.下列方案能达到实验目的是( )| A. | 用浓硫酸干燥NH3 | B. | 用乙醇萃取溴水中的溴单质 | ||
| C. | 用品红溶液鉴别SO2和CO2 | D. | 用焰色反应鉴别KCl和KOH |
分析 A.氨气能够与浓硫酸反应生成硫酸铵;
B.乙醇与水互溶,不能做萃取剂萃取溴水中的溴单质;
C.二氧化硫能够漂白品红溶液,而二氧化碳不具有该性质;
D.二者都含有钾离子,焰色反应的火焰颜色相同.
解答 解:A.浓硫酸与氨气反应,不能用浓硫酸干燥NH3,故A错误;
B.乙醇易溶于水,不能用乙醇萃取溴水中的溴单,故B错误;
C.二氧化硫能够使品红溶液褪色,可以用品红溶液鉴别SO2和CO2,故C正确;
D.KCl和KOH都含有钾离子,焰色反应的火焰相同,不能用焰色反应鉴别KCl和KOH,故D错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,涉及气体干燥、分液、物质检验与鉴别等知识,明确常见元素及其化合物性质为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
7.常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,溶液的pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )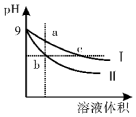

| A. | b、c两点溶液的导电能力b>c | |
| B. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb>Vc | |
| C. | c点溶液中c(H+)=c (OH-)+c(CH3COOH) | |
| D. | a、b、c三点溶液中水的电离程度a>c>b |
5.室温下,由水电离出的 c(H+)=10-11mol/L 溶液中,一定能大量存在的离子是( )
| A. | Fe3+ | B. | CH3COO- | C. | HCO3- | D. | NO3- |
12.下列化学用语表示正确的是( )
| A. | 乙醇的结构简式:C2H6O | |
| B. | 氯化氢的电子式: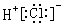 | |
| C. | 镁原子结构示意图: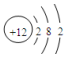 | |
| D. | 氢氧化钠的电离方程式:NaOH═Na++O2-+H+ |
7.常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )

| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | a=0.05 | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol |
8.下列解释物质检验原理的方程式不合理的是( )
| A. | 浓氨水检验泄露的氯气,产生白烟:2NH3+3Cl2═6HCl+N2 | |
| B. | 铁氰化钾检验溶液中Fe2+,产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| C. | 浓溴水检验水体中的苯酚,产生白色沉淀: | |
| D. | 新制Cu(OH)2检验产品中乙醛,产生砖红色沉淀:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.