题目内容
16.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )| A. | 30gC2H6中含有极性共价键的数目为6NA | |
| B. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| C. | 1mol氯气分别与铁和铝完全反应时转移的电子数均为3NA | |
| D. | 25℃,pH=7的NH4Cl和NH3•H2O的混合溶液中,含OH-的数目为10-7NA |
分析 A、求出乙烷的物质的量,然后根据乙烷中含有6条极性共价键来分析;
B、标况下HF为液体;
C、氯气和铝或铁反应后变为-1价;
D、溶液体积不明确.
解答 解:A、30g乙烷的物质的量为1mol,而乙烷中含有6条极性共价键,故1mol乙烷中含6NA条极性共价键,故A正确;
B、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、氯气和铝或铁反应后变为-1价,故1mol氯气转移2NA个电子,故C错误;
D、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
5.室温下,由水电离出的 c(H+)=10-11mol/L 溶液中,一定能大量存在的离子是( )
| A. | Fe3+ | B. | CH3COO- | C. | HCO3- | D. | NO3- |
7.常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )

| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | a=0.05 | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol |
4.如图所示实验中,能够达到目的是( )
| A | B | C | D |
 |  | 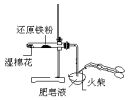 | 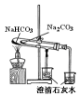 |
| 验证:溶解性AgCl>AgBr>Ag2S | 验证:非金属性Cl>C>Si | 验证:铁粉与水蒸气反应产生的氢气 | 验证:热稳定性 Na2CO3>NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
11. 已知:CH3CH2CH2CH2OH$→_{90~95℃}^{Na_{2}Cr_{2}O_{7}/H+}$CH3CH2CH2CHO
已知:CH3CH2CH2CH2OH$→_{90~95℃}^{Na_{2}Cr_{2}O_{7}/H+}$CH3CH2CH2CHO
利用如图装置用正丁醇合成正丁醛.相关数据如表:
下列说法中,不正确的是( )
 已知:CH3CH2CH2CH2OH$→_{90~95℃}^{Na_{2}Cr_{2}O_{7}/H+}$CH3CH2CH2CHO
已知:CH3CH2CH2CH2OH$→_{90~95℃}^{Na_{2}Cr_{2}O_{7}/H+}$CH3CH2CH2CHO利用如图装置用正丁醇合成正丁醛.相关数据如表:
| 物质 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
| A. | 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中 | |
| B. | 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物 | |
| C. | 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出 | |
| D. | 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇 |
1.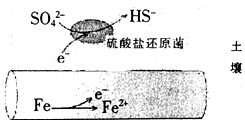 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )| A. | 正极反应为:SO42-+5H2O+8e-=HS-+9OH- | |
| B. | 输送暖气的管道不易发生此类腐蚀 | |
| C. | 这种情况下,Fe腐蚀的最终产物为Fe2O3•xH2O | |
| D. | 管道上刷富锌油漆可以延缓管道的腐蚀 |
8.下列解释物质检验原理的方程式不合理的是( )
| A. | 浓氨水检验泄露的氯气,产生白烟:2NH3+3Cl2═6HCl+N2 | |
| B. | 铁氰化钾检验溶液中Fe2+,产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| C. | 浓溴水检验水体中的苯酚,产生白色沉淀: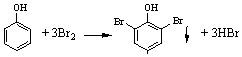 | |
| D. | 新制Cu(OH)2检验产品中乙醛,产生砖红色沉淀:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O |
5.某同学探究NaHCO3的性质,部分实验报吿记录如下:
下列说法不正确的是( )
| ①常温下,配制0.10moI/L NaHCO3溶液,测其pH为8.4; ②取少量该溶液于试管中,向其中滴加CaCl2溶液至中性,滴加过程中只产生一种白色沉淀(能与盐酸作用产生气体),但无气体放出. |
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的水解 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-)、 |