题目内容
13.化学与生产和生活密切相关,下列有关说法正确的是( )| A. | 硅太阳能电池利用的是原电池原理 | |
| B. | 用干燥的钢瓶盛装液氯和用铁制容器盛装容器盛装浓硝酸的原理相同 | |
| C. | 含有活性炭的口罩可阻挡雾霾,其原理是利用活性炭的吸附作用 | |
| D. | 用菜籽油浸泡花椒制得花椒油后,用分液的方法将花椒油分离出来 |
分析 A.硅太阳能电池是将太阳能转化为电能;
B.纯净的氯气与铁不反应,而铁的冷的浓硝酸中发生钝化现象;
C.活性炭具有疏松多孔的结构,具有吸附性;
D.菜籽油浸泡花椒制得花椒油的过程,属于溶解萃取过程,然后用蒸馏的方法将花椒油分离出来;
解答 解:A.硅太阳能电池是将太阳能转化为电能,原电池是将化学能转化为电能,二者原理不同,故A错误;
B.纯净的氯气与铁不反应,而铁的冷的浓硝酸中发生钝化现象,两者原理不同,故B错误;
C.活性炭具有疏松多孔的结构,具有吸附性,则雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理,故C正确;
D.菜籽油浸泡花椒制得花椒油的过程,属于溶解萃取过程,然后用蒸馏的方法将花椒油分离出来,而不是分液,故D错误;
故选C.
点评 本题考查了能量的转化、性质与用途,明确物质的分离方法,熟悉相关物质的结构及性质是解题关键,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
3.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.3 g钠由原子变成离子时,失去的电子数为1NA | |
| B. | 0.2NA个硫酸分子与19.6 g磷酸含有相同的氧原子数 | |
| C. | 28 g氮气所含原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为2:1 |
4.某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是MnO2+4HCl═MnCl4+2H2O.
②II中发生了分解反应,反应的化学方程式是MnCl4═Cl2↑+MnCl2.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:
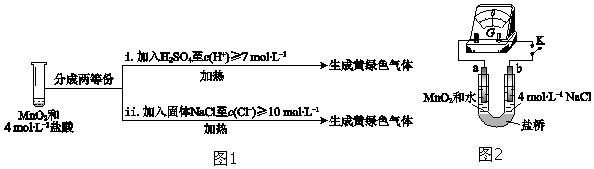
将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;将 i、ii作对比,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-).
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸不能(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
通过实验 I、II、III证明混合气体中含有Cl2,III的操作是将湿润的淀粉KI试纸伸入纯净的NO2中.
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl-)、c(H+)有关.
(1)研究盐酸被MnO2氧化.
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
②II中发生了分解反应,反应的化学方程式是MnCl4═Cl2↑+MnCl2.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:

将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;将 i、ii作对比,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-).
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸不能(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl-)、c(H+)有关.
1.化学已经渗透到人类生活的方方面面.下列说法正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化 | |
| B. | 去皮苹果放在空气中久置变黄与纸张久置变黄原理相似 | |
| C. | 高纯硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| D. | 酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关 |
5.室温下,由水电离出的 c(H+)=10-11mol/L 溶液中,一定能大量存在的离子是( )
| A. | Fe3+ | B. | CH3COO- | C. | HCO3- | D. | NO3- |
4.如图所示实验中,能够达到目的是( )
| A | B | C | D |
 |  | 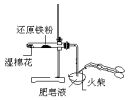 | 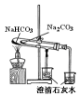 |
| 验证:溶解性AgCl>AgBr>Ag2S | 验证:非金属性Cl>C>Si | 验证:铁粉与水蒸气反应产生的氢气 | 验证:热稳定性 Na2CO3>NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
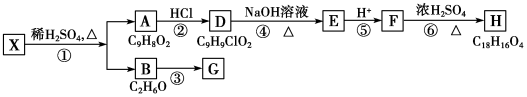
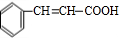 ,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.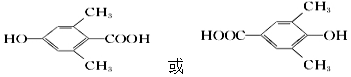 .
. 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.