题目内容
10.下列醇不能由烃和水加成制得的是( )| A. |  | B. |  | C. |  | D. |  |
分析 烯烃和水在一定条件下发生加成反应生成相应的醇,则连接醇羟基碳原子相邻的碳原子上含有氢原子的醇能发生消去反应生成相应的烯烃,否则该醇不能发生消去反应生成相应的烯烃,据此分析解答.
解答 解:A.环己醇中连接醇羟基碳原子相邻的碳原子上有氢原子,所以环己醇能发生消去反应生成相应的烯烃,则环己醇能由烃和水加成而制得,故A不选;
B.2-甲基-2-丙醇中连接醇羟基的碳原子相邻碳原子上含有氢原子,所以能发生消去反应生成2-甲基丙烯,则2-甲基-2-丙醇能由2-甲基丙烯和水发生加成反应而制得,故B不选;
C.2,2-二甲基-1-丙醇中连接醇羟基碳原子相邻的碳原子上没有氢原子,所以2,2-二甲基-1-丙醇不能发生消去反应,则2,2-二甲基-1-丙醇不能用烯烃和水加成得到,故C选;
D.2,3,3-三甲基-2-丁醇中连接醇羟基的碳原子相邻碳原子上含有氢原子,所以能发生消去反应生成2,3,3-三甲基-1-丁烯,则2,3,3-三甲基-2-丁醇可以由2,3,3-三甲基-1-丁烯和水加成制得,故D不选;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确加成反应和消去反应特点是解本题关键,采用逆向思维方法分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
20.向含Fe2(SO4)3、CuCl2、H2SO4的混合溶液中投入足量的Fe粉,充分反应后,剩余的固体物质经干燥,称得其质量比加入的铁粉质量减轻16g,此时溶液中c(Fe2+)是原混合液中c(Cu2+)的3倍(反应前后体积没有变化),溶液中c(SO42-)与c(Cl-)之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 1:1 |
1.化学已经渗透到人类生活的方方面面.下列说法正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化 | |
| B. | 去皮苹果放在空气中久置变黄与纸张久置变黄原理相似 | |
| C. | 高纯硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| D. | 酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关 |
5.室温下,由水电离出的 c(H+)=10-11mol/L 溶液中,一定能大量存在的离子是( )
| A. | Fe3+ | B. | CH3COO- | C. | HCO3- | D. | NO3- |
15.高炉炼铁中存在反应:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,下列说法正确的是( )
| A. | CO是氧化剂 | B. | CO是还原剂 | ||
| C. | CO既是氧化剂又是还原剂 | D. | CO既不是氧化剂又不是还原剂 |
20.用中和滴定法测定某烧碱的纯度.
(1)配制待测液 将0.85g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成100mL溶液,所用的主要仪器有烧杯、玻璃棒、100mL容量瓶、量筒、胶头滴管.
(2)滴定 ①盛装0.20mol/L盐酸标准液应该用酸式滴定管.
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视锥形瓶内溶液的颜色变化和滴定速度,滴定终点时,锥形瓶中的溶液的颜色变化是C.(填编号)
A.由黄色变为红色 B.由黄色变为橙色 C.由浅红色变为无色 D.由无色变为红色
③有关数据记录如表:
(3)纯度计算 NaOH溶液的浓度为0.201mol/L,烧碱样品的纯度为94.6%
(4)对几种假定情况的讨论:(填无影响、偏高、偏低)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果无影响
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果偏高.
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果偏低.
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果偏低.
(1)配制待测液 将0.85g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成100mL溶液,所用的主要仪器有烧杯、玻璃棒、100mL容量瓶、量筒、胶头滴管.
(2)滴定 ①盛装0.20mol/L盐酸标准液应该用酸式滴定管.
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视锥形瓶内溶液的颜色变化和滴定速度,滴定终点时,锥形瓶中的溶液的颜色变化是C.(填编号)
A.由黄色变为红色 B.由黄色变为橙色 C.由浅红色变为无色 D.由无色变为红色
③有关数据记录如表:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
(4)对几种假定情况的讨论:(填无影响、偏高、偏低)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果无影响
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果偏高.
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果偏低.
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果偏低.
1.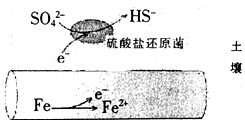 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )| A. | 正极反应为:SO42-+5H2O+8e-=HS-+9OH- | |
| B. | 输送暖气的管道不易发生此类腐蚀 | |
| C. | 这种情况下,Fe腐蚀的最终产物为Fe2O3•xH2O | |
| D. | 管道上刷富锌油漆可以延缓管道的腐蚀 |
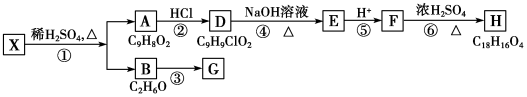
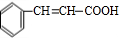 ,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.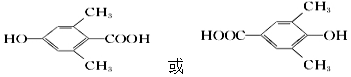 .
. 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.