题目内容
A、B、C、D、E是五种短周期元素,原子序数依次增大.前四种元素的原子序数之和是E的原子序数的2倍.B是形成化合物种类最多的元素,E的阳离子与D的阴离子都比A的阳离子多2个电子层.D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物.回答下列问题:
(1)D在周期表中位置是
(2)B、C、D三种元素原子半径由大到小的顺序是(用相应的元素符号表示)
(3)写出含D质量分数最高的氢化物的电子式 .
(4)A与C的一种化合物为X,其水溶液显碱性请写出对应的化学方程式 实验室制取X的化学方程式为
(5)写出E最高价氧化物对应水化物与过量B的最高价氧化物反应的离子方程式 .
(1)D在周期表中位置是
(2)B、C、D三种元素原子半径由大到小的顺序是(用相应的元素符号表示)
(3)写出含D质量分数最高的氢化物的电子式
(4)A与C的一种化合物为X,其水溶液显碱性请写出对应的化学方程式
(5)写出E最高价氧化物对应水化物与过量B的最高价氧化物反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是五种短周期元素,原子序数依次增大,则E最大为第三周期元素,E阳离子应含有2个电子层,比A阳离子多2个电子层,则A应为H元素,B是形成化合物种类最多的元素,应为C元素,D阴离子都比A阳离子多2个电子层,应为第二周期元素,并且与H、C等都能形成原子个数比不相同的若干种化合物,应为O元素,根据A、B、C、D、E是五种短周期元素,原子序数依次增大,可知C为N元素,有A、B、C、D四种的原子序数之和是E原子序数的二倍,即1+6+7+8=22=2E,所以E的原子序数为11,应为Na元素,据此答题.
解答:
解:A、B、C、D、E是五种短周期元素,原子序数依次增大,则E最大为第三周期元素,E阳离子应含有2个电子层,比A阳离子多2个电子层,则A应为H元素,B是形成化合物种类最多的元素,应为C元素,D阴离子都比A阳离子多2个电子层,应为第二周期元素,并且与H、C等都能形成原子个数比不相同的若干种化合物,应为O元素,根据A、B、C、D、E是五种短周期元素,原子序数依次增大,可知C为N元素,有A、B、C、D四种的原子序数之和是E原子序数的二倍,即1+6+7+8=22=2E,所以E的原子序数为11,应为Na元素,
(1)D为氧元素,在周期表中位置是第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)电子层数相同,核电荷数越多,原子半径越小,所以C、N、O三种元素原子半径由大到小的顺序是C>N>O,故答案为:C>N>O;
(3)含D质量分数最高的氢化物为双氧水,它的电子式为 ,故答案为:
,故答案为: ;
;
(4)A与C的一种化合物为氨气,其水溶液显碱性请写出对应的化学方程式为NH3?H2O?NH4++OH-,实验室制取氨气的化学方程式为Ca(OH)2+2 NH4 Cl
Ca Cl2 +2 H2O+2 NH3↑,
故答案为:NH3?H2O?NH4++OH-;Ca(OH)2+2 NH4 Cl
Ca Cl2 +2 H2O+2 NH3↑;
(5)氢氧化钠与过量二氧化碳反应生成碳酸氢钠,反应的离子方程式为OH-+CO2=HCO3-,故答案为:OH-+CO2=HCO3-.
(1)D为氧元素,在周期表中位置是第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)电子层数相同,核电荷数越多,原子半径越小,所以C、N、O三种元素原子半径由大到小的顺序是C>N>O,故答案为:C>N>O;
(3)含D质量分数最高的氢化物为双氧水,它的电子式为
 ,故答案为:
,故答案为: ;
; (4)A与C的一种化合物为氨气,其水溶液显碱性请写出对应的化学方程式为NH3?H2O?NH4++OH-,实验室制取氨气的化学方程式为Ca(OH)2+2 NH4 Cl
| ||
故答案为:NH3?H2O?NH4++OH-;Ca(OH)2+2 NH4 Cl
| ||
(5)氢氧化钠与过量二氧化碳反应生成碳酸氢钠,反应的离子方程式为OH-+CO2=HCO3-,故答案为:OH-+CO2=HCO3-.
点评:本题主要考查了元素周期表、电子式、半径比较、弱电解质的电离、元素化合物知识,中等难度,元素推断是解题的关键,答题时注意基础知识的灵活运用.

练习册系列答案
相关题目
下列溶液均处于25℃,有关叙述正确的是( )
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B、0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |

 ;
;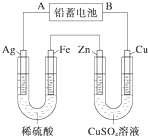 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
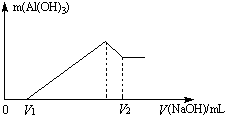 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答: