题目内容
 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
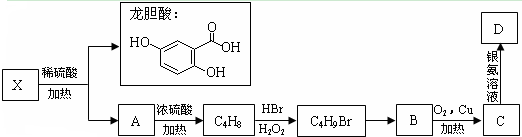
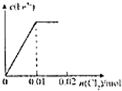
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如图所示.当V1=200mL时,则金属粉末中,n(Mg)=
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13+刚好沉淀完全,则滴入NaOH溶液的体积为
考点:有关混合物反应的计算
专题:计算题
分析:(1)根据图象可知,在滴加NaOH溶液到体积V1=200mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=200mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,根据Mg原子、Al原子、SO42-离子、Na+离子守恒,列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=
计算滴入氢氧化钠溶液体积V2.
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4)求出n(NaOH),再利用V=
计算需要滴入NaOH溶液的体积.
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=
| n |
| c |
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4)求出n(NaOH),再利用V=
| n |
| c |
解答:
解:(1)当V1=200mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=
n(Na+)=
n(NaOH)=
×0.2L×2mol/L=0.2mol,
设MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:24x+27×2y=7.8,
100mL 6mol/L的H2SO4溶液中含有硫酸的物质的量为:6mol/L×0.1L=0.6mol,
根据SO42-离子守恒有:x+3y=0.6-0.2=0.4,
联立方程解得:x=0.1、y=0.1,
所以金属粉末中:n(Mg)=0.1mol,n(Al)=2y=2×0.1mol=0.2mol,
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.6mol×+0.2mol=1.4mol,
则V2=
=0.7L=700mL,
故答案为:0.1,700;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.6mol=1.2mol,
所以需要氢氧化钠溶液体积为:V(NaOH)=
=0.6L=600mL,
故答案为:600.
由Na+离子守恒可知,n(Na2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
设MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:24x+27×2y=7.8,
100mL 6mol/L的H2SO4溶液中含有硫酸的物质的量为:6mol/L×0.1L=0.6mol,
根据SO42-离子守恒有:x+3y=0.6-0.2=0.4,
联立方程解得:x=0.1、y=0.1,
所以金属粉末中:n(Mg)=0.1mol,n(Al)=2y=2×0.1mol=0.2mol,
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.6mol×+0.2mol=1.4mol,
则V2=
| 1.4mol |
| 2mol/L |
故答案为:0.1,700;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.6mol=1.2mol,
所以需要氢氧化钠溶液体积为:V(NaOH)=
| 1.2mol |
| 2mol/L |
故答案为:600.
点评:本题考查了有关混合物反应的计算,题目难度中等,熟练掌握离子性质、明确图象曲线变化的含义为解答此类题的关键,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知NA为阿佛加德罗常数,下列有关叙述中正确的是( )
| A、已知有2mol Na218O2与足量的CO2充分反应,生成的碳酸钠中含18O的原子为NA个 |
| B、电解精炼镍时,当电源提供NA个电子时,阳极溶解的Ni2+应为0.5mol |
| C、标准状况下,22.4L SO2和O2的混合气体中含有的氧原子数为2NA |
| D、向足量MnO2中加入溶有4mol HCl的浓盐酸,加热,反应后的溶液中的Cl-数是2NA个(不考虑盐酸的挥发) |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
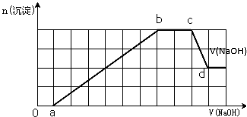

| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |

 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.