题目内容
下列溶液均处于25℃,有关叙述正确的是( )
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B、0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,pH的简单计算,离子浓度大小的比较
专题:
分析:A、同浓度的CaCl2和NaCl溶液中,氯离子浓度不同;
B、据质子守恒判断;
C、含有NH4+、Cl-、H+、OH-的溶液可能显碱性,相同浓度的氯化铵和氨水的混合物显碱性;
D、pH相差2,氢离子浓度相差100倍,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍.
B、据质子守恒判断;
C、含有NH4+、Cl-、H+、OH-的溶液可能显碱性,相同浓度的氯化铵和氨水的混合物显碱性;
D、pH相差2,氢离子浓度相差100倍,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍.
解答:
解:A、同浓度的CaCl2和NaCl溶液中,氯离子浓度不同,对AgCl的溶解平衡抑制作用不同,故A错误;
B、依据质子守恒,Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S),故B错误;
C、含有NH4+、Cl-、H+、OH-的溶液可能显碱性,相同浓度的氯化铵和氨水的混合物显碱性,故C错误;
D、pH相差2,氢离子浓度相差100倍,pPH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故D正确;
故选D.
B、依据质子守恒,Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S),故B错误;
C、含有NH4+、Cl-、H+、OH-的溶液可能显碱性,相同浓度的氯化铵和氨水的混合物显碱性,故C错误;
D、pH相差2,氢离子浓度相差100倍,pPH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故D正确;
故选D.
点评:本题考查了沉淀溶解平衡的移动、溶液中的质子守恒、离子浓度大小比较,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列说法正确的是( )
| A、电子在核外运动时有确定的轨道和轨迹,电子云就是对其运动轨迹的准确描述 |
| B、原子核外电子在某一时刻的位置可以测定或计算出来 |
| C、人们常用小黑点的疏密程度来表示电子在原子核外出现的概率的大小 |
| D、电子云图中的小黑点表示电子的个数多少 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
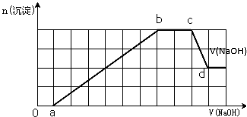

| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |

 将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答: