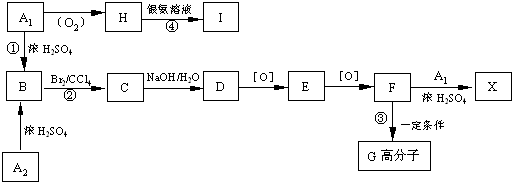
题目内容
0.01mol/LNaCl溶液c(H+)= ,c(OH-)= ,水电离出c(H+)= ,c(OH-)= .
考点:物质的量浓度,水的电离
专题:
分析:依据常温下,KW=(H+)×c(OH-)=10-14计算即可.
解答:
解:NaCl中的氢离子与氢氧根离子均是由水电离出来的,由于NaCl溶液呈中性,即水电离出的氢离子浓度等于氢氧根浓度,即KW=(H+)×c(OH-)=10-14,故c(H+)=
=c(OH-)=10-7,故答案为:10-7mol/L;10-7mol/L;10-7mol/L;10-7mol/L.
| 10-14 |
点评:本题考查了水的电离,明确氢离子浓度、氢氧根离子浓度和离子积常数之间的关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A、根据同周期元素的电负性变化趋势,推出Cl的电负性比S大 |
| B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
| D、根据强酸可以制取弱酸的规律,推出将HCl加入到AgNO3溶液中能制备HNO3 |
 如图所示,该装置能否构成原电池?若能,写出电极方程式.
如图所示,该装置能否构成原电池?若能,写出电极方程式. 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.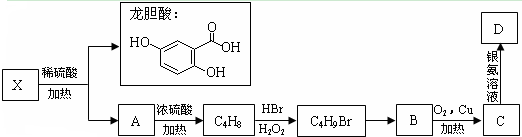
 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验: