题目内容
下列实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 使用100mL的量筒量取一定体积的液体 | 准确量取9.4mL盐酸 |
| B | 用石墨做电极电解等物质的量浓度的NaX和NaY的混合溶液 | 比较X-、Y-的还原性强弱 |
| C | 往浸过火柴头(一般是KClO3、MnO2、S等)的溶液中加AgNO3溶液和稀硝酸 | 检验火柴头中含氯元素 |
| D | 将NH4Cl固体加热分解 | 制取HCl和NH3 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.量取9.4mL盐酸,应选择规格相近的量筒;
B.石墨做电极,溶液中还原性强的离子先得到电子;
C.KClO3与硝酸银不能生成AgCl沉淀;
D.NH4Cl固体加热分解后,又化合生成氯化铵.
B.石墨做电极,溶液中还原性强的离子先得到电子;
C.KClO3与硝酸银不能生成AgCl沉淀;
D.NH4Cl固体加热分解后,又化合生成氯化铵.
解答:
解:A.量取9.4mL盐酸,应选择规格相近的量筒,则应使用10mL的量筒量取,故A错误;
B.石墨做电极,溶液中还原性强的离子先得到电子,则可比较X-、Y-的还原性强弱,故B正确;
C.KClO3与硝酸银不能生成AgCl沉淀,应向加热后的余烬溶于水后加AgNO3溶液和稀硝酸,故C错误;
D.NH4Cl固体加热分解后,又化合生成氯化铵,则不能用于制取HCl和NH3,故D错误;
故选B.
B.石墨做电极,溶液中还原性强的离子先得到电子,则可比较X-、Y-的还原性强弱,故B正确;
C.KClO3与硝酸银不能生成AgCl沉淀,应向加热后的余烬溶于水后加AgNO3溶液和稀硝酸,故C错误;
D.NH4Cl固体加热分解后,又化合生成氯化铵,则不能用于制取HCl和NH3,故D错误;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,把握实验基本操作、电解原理、离子检验及物质的性质等为解答的关键,侧重元素化合物知识及化学反应原理的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
下列物质的分类结果全部正确的是( )
| A、CO-酸性氧化物 Na2O-碱性氧化物 Al2O3-两性氧化物 |
| B、汽油-混合物 胆矾-纯净物 HD-单质 |
| C、苏打-碱 硫化氢-酸 小苏打-酸式盐 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
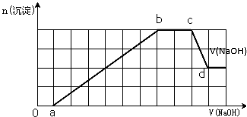

| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |
将0.02molCl2缓缓通入100mL0.2mol/L的FeI2溶液中,此过程中溶液的c(Fe3+)或c(I-)与Cl2的物质的量的关系如图所示(溶液的体积视为不变),正确的是( )
A、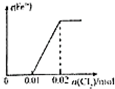 |
B、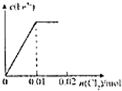 |
C、 |
D、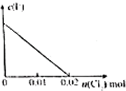 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A、根据同周期元素的电负性变化趋势,推出Cl的电负性比S大 |
| B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
| D、根据强酸可以制取弱酸的规律,推出将HCl加入到AgNO3溶液中能制备HNO3 |
 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验: