题目内容
现有4mol铝及足量稀HCl和稀NaOH溶液,欲将铝全部转化为Al(OH)3,所需HCl与NaOH的物质的量之和最少应是 .
考点:化学方程式的有关计算
专题:计算题
分析:由Al制取Al(OH)3的途径有3种:
①2Al+6H+=2Al3++3H2↑,Al3++3OH-=Al(OH)3↓
②2Al+2OH-+2H2O=2AlO2-+3H2↑,AlO2-+H++H2O=Al(OH)3↓
③2Al+6H+=2Al3++3H2↑,2Al+2OH-+2H2O=2AlO2-+3H2↑,Al3++3AlO2-+6H2O=4Al(OH)3↓
已知Al为4mol,根据方程式计算,消耗的酸和碱的量.
①2Al+6H+=2Al3++3H2↑,Al3++3OH-=Al(OH)3↓
②2Al+2OH-+2H2O=2AlO2-+3H2↑,AlO2-+H++H2O=Al(OH)3↓
③2Al+6H+=2Al3++3H2↑,2Al+2OH-+2H2O=2AlO2-+3H2↑,Al3++3AlO2-+6H2O=4Al(OH)3↓
已知Al为4mol,根据方程式计算,消耗的酸和碱的量.
解答:
解:由Al制取Al(OH)3的途径有3种:
①2Al+6H+=2Al3++3H2↑
4mol 12mol
Al3++3OH-=Al(OH)3↓
4mol 12mol
该方案理论上需要HCl与NaOH共24mol;
②2Al+2OH-+2H2O=2AlO2-+3H2↑
4mol 4mol
AlO2-+H++H2O=Al(OH)3↓
4mol 4mol
该方案理论上需要HCl与NaOH共8mol;
③2Al+6H+=2Al3++3H2↑
1mol 3mol
2Al+2OH-+2H2O=2AlO2-+3H2↑
3mol 3mol 3mol
Al3++3AlO2-+6H2O=4Al(OH)3↓
1mol 3mol
该方案理论上需要HCl与NaOH共6mol;
则所需HCl与NaOH的物质的量之和最少应是6mol.
故答案为:6mol.
①2Al+6H+=2Al3++3H2↑
4mol 12mol
Al3++3OH-=Al(OH)3↓
4mol 12mol
该方案理论上需要HCl与NaOH共24mol;
②2Al+2OH-+2H2O=2AlO2-+3H2↑
4mol 4mol
AlO2-+H++H2O=Al(OH)3↓
4mol 4mol
该方案理论上需要HCl与NaOH共8mol;
③2Al+6H+=2Al3++3H2↑
1mol 3mol
2Al+2OH-+2H2O=2AlO2-+3H2↑
3mol 3mol 3mol
Al3++3AlO2-+6H2O=4Al(OH)3↓
1mol 3mol
该方案理论上需要HCl与NaOH共6mol;
则所需HCl与NaOH的物质的量之和最少应是6mol.
故答案为:6mol.
点评:本题考查了铝及其化合物的转化,侧重于物质之间反应及根据方程式的有关计算,题目难度中等,考查了学生分析问题的能力和计算能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列物质的分类结果全部正确的是( )
| A、CO-酸性氧化物 Na2O-碱性氧化物 Al2O3-两性氧化物 |
| B、汽油-混合物 胆矾-纯净物 HD-单质 |
| C、苏打-碱 硫化氢-酸 小苏打-酸式盐 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
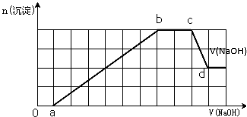

| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A、根据同周期元素的电负性变化趋势,推出Cl的电负性比S大 |
| B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
| D、根据强酸可以制取弱酸的规律,推出将HCl加入到AgNO3溶液中能制备HNO3 |
