题目内容
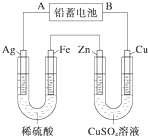 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4| 放电 |
| 充电 |
(1)A是铅蓄电池的
(2)Ag电极的电极反应式是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:当铅蓄电池中转移0.4mol电子时铁电极的质量减小11.2g,说明铁作阳极,银作阴极,连接原电池负极(A)的电极作阴极,连接原电池正极(B)的电极作阳极,原电池负极上失电子发生氧化反应,正极上得电子发生还原反应;故银作阴极,电解稀硫酸时,阴极上氢离子放电生成氢气;铜作阳极,阳极上铜失电子发生氧化反应,阴极上析出铜,所以该装置是电镀池,据此解答即可.
解答:
解:(1)当铅蓄电池中转移0.4mol电子时铁电极的质量减小11.2g,说明铁作阳极,银作阴极,阴极连接原电池负极,所以A是负极,B是正极,正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O,依据电解方程式判断,电解过程中pH值增大,
故答案为:负;PbO2+4H++SO42-+2e-═PbSO4+2H2O;增大;
(2)银作阴极,电解稀硫酸时,阴极上氢离子放电生成氢气,电极反应式为2H++2e-═H2↑,生成氢气的质量=
×2g/mol=0.4g,
故答案为:2H++2e-═H2↑;0.4.
故答案为:负;PbO2+4H++SO42-+2e-═PbSO4+2H2O;增大;
(2)银作阴极,电解稀硫酸时,阴极上氢离子放电生成氢气,电极反应式为2H++2e-═H2↑,生成氢气的质量=
| 0.4mol |
| 2 |
故答案为:2H++2e-═H2↑;0.4.
点评:本题考查了原电池和电解池原理,正确判断原电池正负极是解本题关键,根据离子放电顺序确定阴阳极电极反应,并结合得失电子守恒解答,难度中等.

练习册系列答案
相关题目
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):有关上述反应的叙述正确的是( )
H2(g)+Cl2(g)═2HCl(g)△H1=-Q1 kJ?mol-1
H2(g)+Br2(g)═2HBr(g)△H2=-Q2 kJ?mol-1.
H2(g)+Cl2(g)═2HCl(g)△H1=-Q1 kJ?mol-1
H2(g)+Br2(g)═2HBr(g)△H2=-Q2 kJ?mol-1.
| A、Q1<Q2 |
| B、生成物总能量均高于反应物总能量 |
| C、生成1mol HCl气体时放出Q1热量 |
| D、1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |
已知NA为阿佛加德罗常数,下列有关叙述中正确的是( )
| A、已知有2mol Na218O2与足量的CO2充分反应,生成的碳酸钠中含18O的原子为NA个 |
| B、电解精炼镍时,当电源提供NA个电子时,阳极溶解的Ni2+应为0.5mol |
| C、标准状况下,22.4L SO2和O2的混合气体中含有的氧原子数为2NA |
| D、向足量MnO2中加入溶有4mol HCl的浓盐酸,加热,反应后的溶液中的Cl-数是2NA个(不考虑盐酸的挥发) |
下列物质的分类结果全部正确的是( )
| A、CO-酸性氧化物 Na2O-碱性氧化物 Al2O3-两性氧化物 |
| B、汽油-混合物 胆矾-纯净物 HD-单质 |
| C、苏打-碱 硫化氢-酸 小苏打-酸式盐 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
下列物质属于纯净物( )
| A、液氯 | B、碘酒 |
| C、漂白粉 | D、铝热剂 |