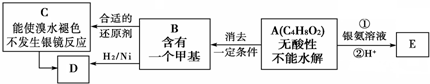
题目内容
制造1000kg普通玻璃,
(1)需要纯碱、石灰石和二氧化硅各多少千克(三者的物质的量之比为1:1:6)?
(2)并计算生产1000kg普通玻璃时,产生的二氧化碳在标准状况下是多少升?
(1)需要纯碱、石灰石和二氧化硅各多少千克(三者的物质的量之比为1:1:6)?
(2)并计算生产1000kg普通玻璃时,产生的二氧化碳在标准状况下是多少升?
考点:化学方程式的有关计算
专题:
分析:工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,以此计算.
解答:
解:工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,该反应的化学方程式为:Na2CO3+SiO2
Na2SiO3+CO2↑,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2
CaSiO3+CO2↑,三者的物质的量之比为1:1:6,普通玻璃以氧化物的形式表示为Na2O?CaO?6SiO2,1000kg玻璃的物质的量为:n=
=
=2.09×103mol,
根据原子守恒可得关系式:Na2O?CaO?6SiO2~Na2CO3~CaCO3~6SiO2~2CO2,
n(Na2O?CaO?6SiO2)=n(Na2CO3)=n(CaCO3)=2.09×103mol,n(SiO2)=6n(Na2O?CaO?6SiO2)=6×2.09×103 mol,n(CO2)=2×2.09×103 mol,
所以:需要Na2CO3:m=n×M=2.09×103 mol×106×10-3kg/mol=221.5 kg
CaCO3:m=n×M=2.09×103 mol×100×10-3kg/mol=209 kg
SiO2:m=n×M=2.09×103 mol×6×60×10-3kg/mol=752.4 kg
(1)由上述分析可知,需要Na2CO3221.5 kg,CaCO3209 kg,SiO2752.4 kg,答:需要Na2CO3221.5 kg,CaCO3209 kg,SiO2752.4 kg
(2)V(CO2)=n×Vm=2×2.09×103 mol×22.4L/mol=9.36×104L,答:共要产生标况下的CO2气体9.36×104升.
| ||
| ||
| m |
| M |
| 1000×103g |
| 478g/mol |
根据原子守恒可得关系式:Na2O?CaO?6SiO2~Na2CO3~CaCO3~6SiO2~2CO2,
n(Na2O?CaO?6SiO2)=n(Na2CO3)=n(CaCO3)=2.09×103mol,n(SiO2)=6n(Na2O?CaO?6SiO2)=6×2.09×103 mol,n(CO2)=2×2.09×103 mol,
所以:需要Na2CO3:m=n×M=2.09×103 mol×106×10-3kg/mol=221.5 kg
CaCO3:m=n×M=2.09×103 mol×100×10-3kg/mol=209 kg
SiO2:m=n×M=2.09×103 mol×6×60×10-3kg/mol=752.4 kg
(1)由上述分析可知,需要Na2CO3221.5 kg,CaCO3209 kg,SiO2752.4 kg,答:需要Na2CO3221.5 kg,CaCO3209 kg,SiO2752.4 kg
(2)V(CO2)=n×Vm=2×2.09×103 mol×22.4L/mol=9.36×104L,答:共要产生标况下的CO2气体9.36×104升.
点评:本题考查化学反应方程式的计算,为高频考点,把握硅酸盐的组成和原子守恒法的计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
A、B、C、D四种短周期元素原子序数依次增大,A原子为半径最小的原子,C原子最外层电子数与A、B原子最外层电子数之和相等,D原子和B原子最外层电子数的和为C原子最外层电子数的2倍,D原子的最外层电子数为电子层数的3倍.下列说法正确的是( )
| A、原子半径大小顺序为:B>C>D>A |
| B、四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C元素位于元素周期表中第二周期,D元素位于元素周期表中第三周期 |
| D、BA4、CA4+两种微粒都具有正四面体结构,B、C、D三种元素都有属于分子晶体、原子晶体的同素异形体 |
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素,原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等.下列说法不正确的是( )
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
对于反应2A(g)+B(g)?2C(g)△H<0,下列图象正确的是( )


| A、①④ | B、②③ | C、①③ | D、②④ |
一种从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下下列说法中正确的是( )
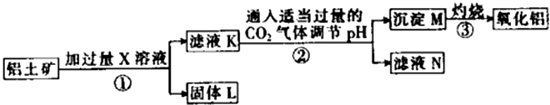

| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |
在100mL AlCl3溶液中逐滴加入KOH溶液,当KOH溶液的体积为30mL和70mL时,所得沉淀质量相等,则原AlCl3溶液和KOH溶液的物质的量浓度之比为( )
| A、5:1 | B、1:5 |
| C、3:7 | D、7:3 |
 原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答: