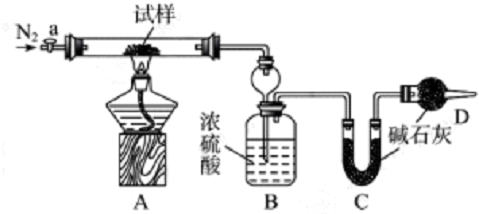
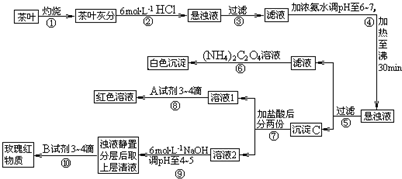
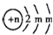题目内容
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素,原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等.下列说法不正确的是( )
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、Z、R、W五种元素原子序数依次增大,W原子的最外层电子数比内层电子总数少4,则W应处于第三周期,原子最外层电子数为:10-4=6,则W为S元素;
Y与W为同主族元素,则Y为O元素;X的原子序数小于O元素,原子半径也小于O原子半径,且为主族元素,可知X为H元素;
X与Z为同主族元素,Z的原子序数大于氧元素,则Z为Na元素;
Z、R的核外电子数之和与Y、W核外电子数之和相等,则R的核外电子数为:8+16-11=13,则R为Al元素,
根据以上分析可知:X为H元素、Y为O元素、Z为Na元素、R为Al元素、W为S元素.
Y与W为同主族元素,则Y为O元素;X的原子序数小于O元素,原子半径也小于O原子半径,且为主族元素,可知X为H元素;
X与Z为同主族元素,Z的原子序数大于氧元素,则Z为Na元素;
Z、R的核外电子数之和与Y、W核外电子数之和相等,则R的核外电子数为:8+16-11=13,则R为Al元素,
根据以上分析可知:X为H元素、Y为O元素、Z为Na元素、R为Al元素、W为S元素.
解答:
解:短周期元素X、Y、Z、R、W五种元素原子序数依次增大,W原子的最外层电子数比内层电子总数少4,则W应处于第三周期,原子最外层电子数为10-4=6,则W为硫元素;Y与W为同主族元素,则Y为氧元素;X的原子序数小于氧元素,原子半径也小于O原子半径,且为主族元素,可知X为氢元素;X与Z为同主族元素,Z的原子序数大于氧元素,则Z为Na元素;Z、R的核外电子数之和与Y、W核外电子数之和相等,则R的核外电子数为8+16-11=13,则R为Al元素,
X为H元素、Y为O元素、Z为Na元素、R为Al元素、W为S元素,
A.Z为Na元素、R为Al元素,工业上通常用电解熔融的氧化铝、NaCl的方法获得,故A正确;
B.Y、Z、R的简单离子分别为O2-、Na+、Al3+,三者的电子层结构相同,故B正确;
C.H与O、H与S形成的化合物中,硫化氢在空气中易被氧化而变质,而水不变质,故C错误;
D.X、Y、Z形成的化合物为NaOH,X、Y、R形成的化合物为氢氧化铝,氢氧化钠能与氢氧化铝发生复分解反应生成偏铝酸钠与水,故D正确;
故选C.
X为H元素、Y为O元素、Z为Na元素、R为Al元素、W为S元素,
A.Z为Na元素、R为Al元素,工业上通常用电解熔融的氧化铝、NaCl的方法获得,故A正确;
B.Y、Z、R的简单离子分别为O2-、Na+、Al3+,三者的电子层结构相同,故B正确;
C.H与O、H与S形成的化合物中,硫化氢在空气中易被氧化而变质,而水不变质,故C错误;
D.X、Y、Z形成的化合物为NaOH,X、Y、R形成的化合物为氢氧化铝,氢氧化钠能与氢氧化铝发生复分解反应生成偏铝酸钠与水,故D正确;
故选C.
点评:本题考查位置结构性质的关系及应用,题目难度中等,正确推断元素名称是解题关键,注意根据原子半径确定元素的方法,明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
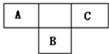 于B原子的质子数,B2-的结构示意图为:
于B原子的质子数,B2-的结构示意图为: