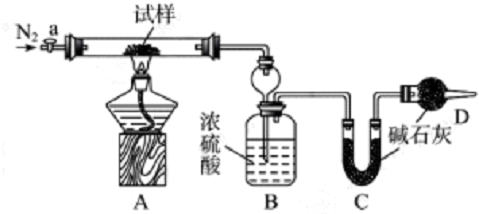
��Ŀ����
��ȸʯ��ʯ������Ȼ����ڵ�����̼������ͭ�����ǵĻ�ѧ��ɿɱ�ʾΪ��xCuCO3?yCu��OH��2��x��yΪ����������x��2��y��2��
��1����ȸʯ��ʯ��ֱ���������ᷴӦʱ����ȸʯ���õ���������ʵ��������ɵ�CO2�����ʵ���֮��Ϊ4��1��ʯ����Ϊ3��1�����������ǵĻ�ѧ��ɣ���ȸʯ�� ��ʯ�ࣺ ��
��2�����п�ȸʯ��ʯ������Ʒ��ȡ���ݵ���������Ʒ����һ���м���������ᣬ����CO2 3.36L����״���£���������һ����Ʒʹ����ȫ�ֽ⣬�õ�CuO 20g����ͨ������ȷ���û�����п�ȸʯ��ʯ������ʵ���֮�ȣ�
��1����ȸʯ��ʯ��ֱ���������ᷴӦʱ����ȸʯ���õ���������ʵ��������ɵ�CO2�����ʵ���֮��Ϊ4��1��ʯ����Ϊ3��1�����������ǵĻ�ѧ��ɣ���ȸʯ��
��2�����п�ȸʯ��ʯ������Ʒ��ȡ���ݵ���������Ʒ����һ���м���������ᣬ����CO2 3.36L����״���£���������һ����Ʒʹ����ȫ�ֽ⣬�õ�CuO 20g����ͨ������ȷ���û�����п�ȸʯ��ʯ������ʵ���֮�ȣ�
���㣺ͭ����������Ҫ���������Ҫ����,��ѧ����ʽ���йؼ���
ר�⣺
��������1���ÿ�ȸʯ���õ����������ɵ�CO2�����ʵ�����Ϊ4��1���������ѧ��ɿɱ�ʾΪxCuCO3?yCu��OH��2��x��y�ıȣ��ٸ���x��yΪ��������x��2��y��2�������������ƶϳ������ʵĻ�ѧ��ɣ�������Ӧ��xCuCO3?yCu��OH��2+��2x+2y��HCl�T��x+y��CuCl2+xCO2��+��x+2y��H2O���������ѧ��ɿɱ�ʾΪxCuCO3?yCu��OH��2��x��y��ϵ���ٸ���x��yΪ��������x��2��y��2�������������
��2�����ȸʯ��ʯ������ʵ����ֱ�Ϊamol��bmol�����ݷ���ʽ��ʾ�����ɵĶ�����̼��CuO���з��̼�����
��2�����ȸʯ��ʯ������ʵ����ֱ�Ϊamol��bmol�����ݷ���ʽ��ʾ�����ɵĶ�����̼��CuO���з��̼�����
���
�⣺��1�����ݿ�ȸʯ���õ����������ɵ�CO2�����ʵ�����Ϊ4��1��
�ͻ�ѧ����ʽxCuCO3?yCu��OH��2+2��x+y��HCl����x+y��CuCl2+xCO2��+��x+2y��H2O
��֪��2��x+y����x=4��1���ɵ�x��y=1��1��
��x��y��������x��2��y��2��
���ȸʯ�Ļ�ѧʽ�ɱ�ʾΪCuCO3?Cu��OH��2��
��ʯ�����Ӧ��xCuCO3?yCu��OH��2+��2x+2y��HCl�T��x+y��CuCl2+xCO2��+��x+2y��H2O��ʯ����õ����������ɵ�CO2�����ʵ�����Ϊ3��1����2x+2y����x=3��1�����x=2y��
��x��y��������x��2��y��2����x=2��y=1��
��ʯ��Ļ�ѧʽ�ɱ�ʾΪ2CuCO3?Cu��OH��2��
�ʴ�Ϊ��CuCO3?Cu��OH��2��2CuCO3?Cu��OH��2��
��2�����ȸʯ��ʯ������ʵ����ֱ�Ϊamol��bmol����
CuCO3?Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O
1 1
amol amol
2CuCO3?Cu��OH��2+6HCl�T3CuCl2+2CO2��+4H2O
1 2
bmol 2bmol
CuCO3?Cu��OH��2
2CuO+CO2��+H2O
1mol 160g
amol 160ag
2CuCO3?Cu��OH��2
3CuO+2CO2��+H2O
1mol 240
bmol 240bg
��a+2b=
��160ag+240bg=20g��
��֮��a=0.05��b=0.05
�û�����п�ȸʯ��ʯ������ʵ���֮��=0.05mol��0.05mol=1��1��
�𣺿�ȸʯ��ʯ������ʵ���֮��Ϊ1��1��
�ͻ�ѧ����ʽxCuCO3?yCu��OH��2+2��x+y��HCl����x+y��CuCl2+xCO2��+��x+2y��H2O
��֪��2��x+y����x=4��1���ɵ�x��y=1��1��
��x��y��������x��2��y��2��
���ȸʯ�Ļ�ѧʽ�ɱ�ʾΪCuCO3?Cu��OH��2��
��ʯ�����Ӧ��xCuCO3?yCu��OH��2+��2x+2y��HCl�T��x+y��CuCl2+xCO2��+��x+2y��H2O��ʯ����õ����������ɵ�CO2�����ʵ�����Ϊ3��1����2x+2y����x=3��1�����x=2y��
��x��y��������x��2��y��2����x=2��y=1��
��ʯ��Ļ�ѧʽ�ɱ�ʾΪ2CuCO3?Cu��OH��2��
�ʴ�Ϊ��CuCO3?Cu��OH��2��2CuCO3?Cu��OH��2��
��2�����ȸʯ��ʯ������ʵ����ֱ�Ϊamol��bmol����
CuCO3?Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O
1 1
amol amol
2CuCO3?Cu��OH��2+6HCl�T3CuCl2+2CO2��+4H2O
1 2
bmol 2bmol
CuCO3?Cu��OH��2
| ||
1mol 160g
amol 160ag
2CuCO3?Cu��OH��2
| ||
1mol 240
bmol 240bg
��a+2b=
| 3.36L |
| 22.4L/mol |
��֮��a=0.05��b=0.05
�û�����п�ȸʯ��ʯ������ʵ���֮��=0.05mol��0.05mol=1��1��
�𣺿�ȸʯ��ʯ������ʵ���֮��Ϊ1��1��
���������⿼�黯ѧʽ���ƶϡ���ѧ��Ӧ����ʽ�ļ��㣬ע����ݷ���ʽ���м�������Ŀ�Ѷ��еȣ������ڿ���ѧ���ķ��������ͼ���������

��ϰ��ϵ�д�
�����Ŀ
25��ʱ����Ũ�ȶ�Ϊ0.1mol?L-1�İ�ˮ���������ƻ����Һ�еμ�0.1mol?L-1��ijһԪ��HA������˵����ȷ���ǣ�������
| A��������HA����ҺpH=7ʱ����Һ�еļδ��Ӧ�� |
| B���ڵμ�HA�Ĺ����У�ˮ�ĵ���̶��ȼ�С������ |
| C���ڵμ�HA�Ĺ����У���Һ�п��ܴ�������Ũ�ȹ�ϵ��c��A-����c��Na+����c��NH4+����c��H+����c��OH-�� |
| D����Ӧ�����յ�ʱ��c��NH4+��+c��NH3?H2O��=0.1mol?L-1 |
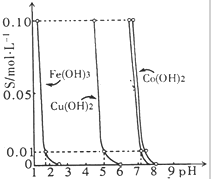 ��ͼ��ʾ����25��ʱ��Fe��OH��3��Cu��OH��2��Co��OH��2�������ڲ�ͬpH�µ��ܽ��ԣ�cΪ��Һ�������ӵ����ʵ���Ũ�ȣ���
��ͼ��ʾ����25��ʱ��Fe��OH��3��Cu��OH��2��Co��OH��2�������ڲ�ͬpH�µ��ܽ��ԣ�cΪ��Һ�������ӵ����ʵ���Ũ�ȣ���