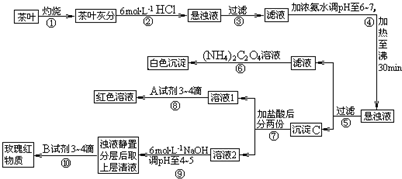
题目内容
一种从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下下列说法中正确的是( )
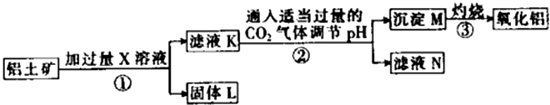

| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:铝土矿中含有MgO、Fe2O3、Al2O3、SiO2,加入过量的X溶液后得到固体L和溶液K,向溶液K中加入过量二氧化碳后得到沉淀M,灼烧沉淀M得到氧化铝,则沉淀M为Al(OH)3,溶液K中含有偏铝酸根离子,所以加入的溶液X为氢氧化钠溶液,则制备流程为:铝土矿中加入过量氢氧化钠溶液,MgO、Fe2O3不与NaOH溶液反应,Al2O3、SiO2与NaOH溶液反应生成偏铝酸钠、硅酸钠,则固体L为MgO、Fe2O3的混合物,滤液N中含有偏铝酸根离子、硅酸根离子;向滤液K中加入过量二氧化碳并调节溶液的pH后,发生反应:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,生成沉淀M氢氧化铝,加热氢氧化铝分解生成氧化铝,据此对各选项进行判断.
解答:
解:根据图示流程可知,制备Al2O3方法为为:铝土矿中加入过量氢氧化钠溶液,MgO、Fe2O3、SiO2不与NaOH溶液反应,Al2O3、SiO2与NaOH溶液反应生成偏铝酸钠、硅酸钠,则固体L为MgO、Fe2O3的混合物,滤液K中含有偏铝酸根离子,向滤液K中加入过量二氧化碳且调节pH后,发生反应:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,生成沉淀M为氢氧化铝,加热Al(OH)3分解生成Al2O3,滤液N中含有硅酸钠、碳酸氢钠,
A.根据分析可知,加入的X必须为强碱溶液,不能加入盐酸,故A错误;
B.第②步中通入过量的二氧化碳气体,则反应 生成碳酸氢钠,正确的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故B错误;
C.MgO、Fe2O3不与NaOH溶液反应,则固体L为MgO、Fe2O3的混合物,故C正确;
D.滤液N中含有硅酸钠、碳酸氢钠,蒸干滤液N会得到硅酸钠固体,无法获得纯净的碳酸钠,故D错误;
故选C.
A.根据分析可知,加入的X必须为强碱溶液,不能加入盐酸,故A错误;
B.第②步中通入过量的二氧化碳气体,则反应 生成碳酸氢钠,正确的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故B错误;
C.MgO、Fe2O3不与NaOH溶液反应,则固体L为MgO、Fe2O3的混合物,故C正确;
D.滤液N中含有硅酸钠、碳酸氢钠,蒸干滤液N会得到硅酸钠固体,无法获得纯净的碳酸钠,故D错误;
故选C.
点评:本题考查了物质的分离与提纯方法的综合应用,题目难度中等,正确分析提纯流程为解答关键,注意掌握常见元素单质及其化合物性质,明确化学实验基本操作方法及其应用方法,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,B元素的原子核内质子数等于中子数,下列叙述不正确的是( )
| B | ||
| A | C |
| A、A为ⅤA族元素 |
| B、B为第二周期的元素 |
| C、C是周期表中化学性质最活泼的非金属 |
| D、三种元素都为非金属元素 |
下列物质的电离方程式,正确的是( )
| A、加热NH4HCO3至熔融状态:NH4HCO3═NH4++HCO3? |
| B、CO2通入水中得到H2CO3:H2CO3═2H++CO32? |
| C、醋酸钠溶于水:CH3COONa═CH3COO-+Na+ |
| D、C2H5OH溶于水:C2H5OH═C2H5++OH- |