题目内容
 原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:(1)写出N在周期表中的位置:
(2)用电子式表示Z与M形成化合物的过程
(3)X、Y、M的电负性由小到大的顺序是
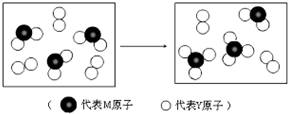
(4)如图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:
考点:位置结构性质的相互关系应用,元素电离能、电负性的含义及应用,极性键和非极性键
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.X是迄今为止形成化合物最多的元素,则X为碳元素;Y原子最外层电子数与核外电子总数之比为3:4,则Y为氧元素;W是第Ⅷ族元素中原子序数最小的元素,则W为Fe;M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物,可知M可能为S元素,Z、M、N 同周期,形成的M2-、N-、Z+ 离子半径逐渐减小,结合原子序数可知,三种元素只能处于第三周期,可推知M为S、N为Cl、Z为Na,据此答题;
解答:
解:原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.X是迄今为止形成化合物最多的元素,则X为碳元素;Y原子最外层电子数与核外电子总数之比为3:4,则Y为氧元素;W是第Ⅷ族元素中原子序数最小的元素,则W为Fe;M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物,可知M可能为S元素,Z、M、N 同周期,形成的M2-、N-、Z+ 离子半径逐渐减小,结合原子序数可知,三种元素只能处于第三周期,可推知M为S、N为Cl、Z为Na,
(1)N为Cl元素,在周期表中的位置是:第三周期ⅦA族,化学键C-Cl,属于极性共价键,
故答案为:第三周期ⅦA族;极性共价键;
(2)Z与M形成化合物为Na2S,用电子式表示形成过程为: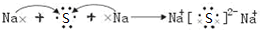 ,
,
故答案为: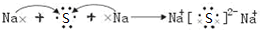 ;
;
(3)同主族自上而下电负性减弱,故电负性S<O,非金属性C<S,故电负性C<S,电负性由小到大的顺序是C<S<O;N3-与C、O形成的一种化合物CO2为等电子体,二者结构相似,所以N3-的空间构型为直线型,
故答案为:C<S<O;直线型;
(4)根据图1可知,前面是二氧化硫,后面是三氧化硫,所以反应为2SO2+O2
2SO3,故答案为:2SO2+O2
2SO3;
(1)N为Cl元素,在周期表中的位置是:第三周期ⅦA族,化学键C-Cl,属于极性共价键,
故答案为:第三周期ⅦA族;极性共价键;
(2)Z与M形成化合物为Na2S,用电子式表示形成过程为:
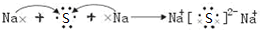 ,
,故答案为:
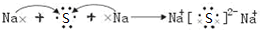 ;
;(3)同主族自上而下电负性减弱,故电负性S<O,非金属性C<S,故电负性C<S,电负性由小到大的顺序是C<S<O;N3-与C、O形成的一种化合物CO2为等电子体,二者结构相似,所以N3-的空间构型为直线型,
故答案为:C<S<O;直线型;
(4)根据图1可知,前面是二氧化硫,后面是三氧化硫,所以反应为2SO2+O2
| ||
| △ |
| ||
| △ |
点评:本题主要考查了电子式、核外电子排布、电负性等知识点,推断元素是解题关键,难度中等,答题时注意基础知识的灵活运用.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
25℃时,往浓度都为0.1mol?L-1的氨水和氢氧化钠混合溶液中滴加0.1mol?L-1的某一元酸HA,下列说法正确的是( )
| A、当加入HA至溶液pH=7时,溶液中的碱还未反应完 |
| B、在滴加HA的过程中,水的电离程度先减小后增加 |
| C、在滴加HA的过程中,溶液中可能存在如下浓度关系:c(A-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
| D、反应到达终点时:c(NH4+)+c(NH3?H2O)=0.1mol?L-1 |
无机化学命名委员会(国际组织)在1989年作出决定,把长式元素周期表原先的主、副族 及族号取消,由左到右改为18列,如碱金属族为第1列,稀有气体元素为第18列.按此规定,下列说法中错误的是( )
| A、第17、18列都是非金属元素 |
| B、第1列元素和第17列元素的单质熔、沸点变化趋势相反 |
| C、只有第2列元素原子最外层有2个电子 |
| D、在18列元素中,第3列元素种类最多 |
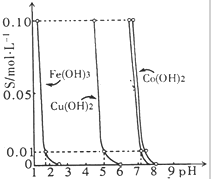 如图所示的是25℃时,Fe(OH)3、Cu(OH)2、Co(OH)2等物质在不同pH下的溶解性(c为溶液中阳离子的物质的量浓度).
如图所示的是25℃时,Fe(OH)3、Cu(OH)2、Co(OH)2等物质在不同pH下的溶解性(c为溶液中阳离子的物质的量浓度).