题目内容
在100mL AlCl3溶液中逐滴加入KOH溶液,当KOH溶液的体积为30mL和70mL时,所得沉淀质量相等,则原AlCl3溶液和KOH溶液的物质的量浓度之比为( )
| A、5:1 | B、1:5 |
| C、3:7 | D、7:3 |
考点:化学方程式的有关计算
专题:
分析:在100mL AlCl3溶液中逐滴加入KOH溶液,当KOH溶液的体积为30mL和70mL时,所得沉淀质量相等,说明加入30mLKOH溶液时,KOH不足,AlCl3有剩余,根据氢氧根离子守恒,3n[Al(OH)3]=n(KOH);
加入70mLKOH溶液时,AlCl3完全反应,生成氢氧化铝与偏铝酸钾、KCl,根据Al元素守恒n(AlCl3)=n[Al(OH)3]+n(KAlO2),根据钾离子守恒n(KAlO2)+n(KCl)=n(KOH),根据氯离子守恒,可知溶液中n(KCl)=3n(AlCl3),令AlCl3溶液的浓度为amol/L,KOH的浓度为bmol/L,表示出两种情况下氢氧化铝的物质的量,进而确定二者浓度.
加入70mLKOH溶液时,AlCl3完全反应,生成氢氧化铝与偏铝酸钾、KCl,根据Al元素守恒n(AlCl3)=n[Al(OH)3]+n(KAlO2),根据钾离子守恒n(KAlO2)+n(KCl)=n(KOH),根据氯离子守恒,可知溶液中n(KCl)=3n(AlCl3),令AlCl3溶液的浓度为amol/L,KOH的浓度为bmol/L,表示出两种情况下氢氧化铝的物质的量,进而确定二者浓度.
解答:
解:令AlCl3溶液的浓度为amol/L,KOH的浓度为bmol/L,
在100mL AlCl3溶液中逐滴加入KOH溶液,当KOH溶液的体积为30mL和70mL时,所得沉淀质量相等,说明加入30mLKOH溶液时,KOH不足,AlCl3有剩余,根据氢氧根离子守恒,n[Al(OH)3]=
n(KOH)=
×0.03L×b mol/L=0.01b mol;
加入70mLKOH溶液时,AlCl3完全反应,其物质的量为0.1L×a mol/L=0.1a mol,反应生成氢氧化铝与偏铝酸钾、KCl,根据氯离子守恒,可知溶液中n(KCl)=3n(AlCl3)=0.3a mol,根据钾离子守恒n(KAlO2)+n(KCl)=n(KOH),故n(KAlO2)=0.07L×b mol/L-0.3a mol=(0.07b-0.3a)mol,根据Al元素守恒n(AlCl3)=n[Al(OH)3]+n(KAlO2),则n[Al(OH)3]=0.1a mol-(0.07b-0.3a)mol=(0.4a-0.07b)mol,
则0.01b mol=(0.4a-0.07b)mol,整理得a:b=1:5,
故选B.
在100mL AlCl3溶液中逐滴加入KOH溶液,当KOH溶液的体积为30mL和70mL时,所得沉淀质量相等,说明加入30mLKOH溶液时,KOH不足,AlCl3有剩余,根据氢氧根离子守恒,n[Al(OH)3]=
| 1 |
| 3 |
| 1 |
| 3 |
加入70mLKOH溶液时,AlCl3完全反应,其物质的量为0.1L×a mol/L=0.1a mol,反应生成氢氧化铝与偏铝酸钾、KCl,根据氯离子守恒,可知溶液中n(KCl)=3n(AlCl3)=0.3a mol,根据钾离子守恒n(KAlO2)+n(KCl)=n(KOH),故n(KAlO2)=0.07L×b mol/L-0.3a mol=(0.07b-0.3a)mol,根据Al元素守恒n(AlCl3)=n[Al(OH)3]+n(KAlO2),则n[Al(OH)3]=0.1a mol-(0.07b-0.3a)mol=(0.4a-0.07b)mol,
则0.01b mol=(0.4a-0.07b)mol,整理得a:b=1:5,
故选B.
点评:本题考查化学方程式的有关计算,注意理解利用守恒方法计算,利用赋值法结合方程式计算较为简单.

练习册系列答案
相关题目
 于B原子的质子数,B2-的结构示意图为:
于B原子的质子数,B2-的结构示意图为:
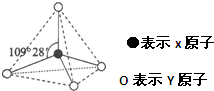
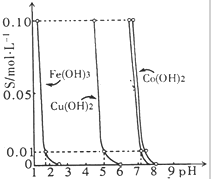 如图所示的是25℃时,Fe(OH)3、Cu(OH)2、Co(OH)2等物质在不同pH下的溶解性(c为溶液中阳离子的物质的量浓度).
如图所示的是25℃时,Fe(OH)3、Cu(OH)2、Co(OH)2等物质在不同pH下的溶解性(c为溶液中阳离子的物质的量浓度).