题目内容
11.完成下面各小题:(1)命名:
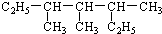 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷(2)如果(1)中的烷烃是由炔烃与H2加成得到的,则可能的炔烃有1种.
(3)若先将CH3CH2CH2Cl与NaOH溶液共热,然后用硝酸酸化,再滴加AgNO3溶液,现象为生成白色沉淀,主要的反应方程式为CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH2CH2OH+NaCl、NaCl+AgNO3=AgCl+NaNO3.
分析 (1) 为烷烃,将两个乙基展开后,最长碳链含有7个C,主链为庚烷,编号从两端都可以,然后根据烷烃的命名原则写出其名称;
为烷烃,将两个乙基展开后,最长碳链含有7个C,主链为庚烷,编号从两端都可以,然后根据烷烃的命名原则写出其名称;
(2)炔烃中含有碳碳三键,在相邻的两个C原子之间添加三键,只有一种添加方式;
(3)CH3CH2CH2Cl与NaOH醇溶液共热生成CH3CH2CH2OH、NaCl,据此写出反应的化学方程式.
解答 解:(1) 中含有两个乙基的碳链为主链,最长碳链含有7个碳,主链为庚烷,在3、4、5号C各含有1个甲基,该有机物名称为:3,3,5-三甲基庚烷,
中含有两个乙基的碳链为主链,最长碳链含有7个碳,主链为庚烷,在3、4、5号C各含有1个甲基,该有机物名称为:3,3,5-三甲基庚烷,
故答案为:3,3,5-三甲基庚烷;
(2)如果烷烃 是由炔烃与H2加成得到的,则炔烃的结构简式只有1种,
是由炔烃与H2加成得到的,则炔烃的结构简式只有1种,
故答案为:1;
(3)CH3CH2CH2Cl与NaOH醇溶液共热发生水解反应生成CH3CH2CH2OH、NaCl,反应的化学方程式为:CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH2CH2OH+NaCl,用硝酸酸化,再滴加AgNO3溶液生成白色沉淀,NaCl+AgNO3=AgCl+NaNO3,
故答案为:生成白色沉淀;CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH2CH2OH+NaCl;NaCl+AgNO3=AgCl+NaNO3.
点评 本题考查了有机物的命名、卤代烃的性质等知识,题目难度中等,注意掌握常见有机物的命名原则,明确有机反应原理是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.(Ⅰ)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
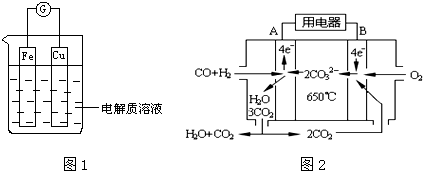
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
①CH4和NO2反应正反应为放热反应(填“放热”或“吸热”);
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
| 时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
2.(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下:
则X、Y、Z三种元素中原子半径最小的是Al(填元素符号),三种元素中有两种元素的最高价氧化物对应的水化物能相互反应,写出反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,分子间作用力大因而易液化.
②W分子的VSEPR模型的空间构型为四面体型.
③写出AB-离子的电子式:[:C??N:]-.
(3))E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E、F、G三元素的元素符号分别为K、、Cr、Cu.
②F元素在其化合物中最高化合价为+6.
③G2+离子的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.G2+和N分子形成的配离子的结构式为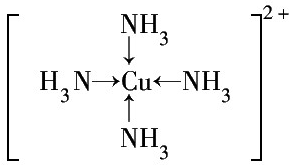 .
.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,分子间作用力大因而易液化.
②W分子的VSEPR模型的空间构型为四面体型.
③写出AB-离子的电子式:[:C??N:]-.
(3))E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E、F、G三元素的元素符号分别为K、、Cr、Cu.
②F元素在其化合物中最高化合价为+6.
③G2+离子的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.G2+和N分子形成的配离子的结构式为
 .
.
19.常温下,下列有关稀溶液中离子浓度的说法正确的是( )
| A. | 同浓度的四种溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2溶液,c(NH4+)浓度的大小关系:②>④>③>① | |
| B. | 一定浓度的NaHS溶液中:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 若0.1 mol/L NH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1-10-5)mol/L | |
| D. | 现有四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水电离出的氢离子浓度大小关系为:②=④>③>① |
6.下列各组混合物中,可以用分液漏斗分离的是( )
| A. | 溴苯和水 | B. | 溴乙烷和乙醇 | C. | 甘油和水 | D. | 溴苯和苯 |
 .
. ;
;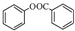 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).