题目内容
20.KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度.请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是将水中还原性物质完全氧化.
(2)如何保证在70℃~80℃条件下进行滴定操作:水浴加热,用温度计控制水温.
(3)准确量取一定体积的KMnO4溶液用酸式滴定管(填仪器名称).
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用A(填序号).
A.H2C2O4•2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(5)若准确称取Wg你选的基准试剂溶于水配成500mL水溶液,取25.00mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL.问:
①滴定终点标志是滴定终点时最后滴下1滴KMnO4溶液后变色而且半分钟不褪色;
②所配制KMnO4标准溶液的物质的量浓度为W/6.3Vmol/L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将偏高(填“偏高”或“偏低”).
分析 (1)水中有还原性物质能与反应KMnO4;
(2)加热温度低于100℃时,一般采用水浴加热;
(3)KMnO4溶液具有强氧化性用酸式滴定管量取;
(4)选做基准试剂的物质必须满足纯度高、稳定性好,如硫酸亚铁、亚硫酸钠容易被氧化变质的试剂不能作为基准试剂,浓盐酸具有挥发性,也不能做基准试剂;
(5)①滴定终点时最后滴下1滴KMnO4溶液后变色而且半分钟不褪色;
②先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度;
(6)长时间放置后,高锰酸钾溶液浓度变小.
解答 解:(1)由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,所以要除去水中的还原性物质,则将溶液加热并保持微沸1h的目的是将水中还原性物质完全氧化;
故答案为:将水中还原性物质完全氧化;
(2)加热温度低于100℃时,一般采用水浴加热,则要保证在70℃~80℃条件下进行滴定操作,应该水浴加热,用温度计控制水温;
故答案为:水浴加热,用温度计控制水温;
(3)KMnO4溶液具有强氧化性能氧化碱式滴定管中的橡胶管,所以不能用碱式滴定管量取,应该用酸式滴定管量取;
故答案为:酸式滴定管;
(4)A.H2C2O4•2H2O常温下是稳定的结晶水水化物,溶于水后纯度高、稳定性好,可以用作基准试剂,故A正确;
B.FeSO4在空气中不稳定,亚铁离子容易被氧化成铁离子,不宜用作基准试剂,故B错误;
C.浓盐酸不稳定,易挥发,不宜用作基准试剂,故C错误;
D.Na2SO3具有还原性,在空气中容易被氧化成硫酸钠,不宜用作基准试剂,故D错误;
故答案为:A;
(5)①滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟不褪色,说明滴定到达终点;
故答案为:滴下最后一滴KMnO4溶液后,溶液变成紫红色且半分钟内不褪色;
②草酸的物质的量浓度为:$\frac{\frac{Wg}{126g/mol}}{0.5L}$=$\frac{W}{63}$Wmol/L,根据反应方程式6H++2MnO4-+5H2C2O4•2H2O═2Mn2++10CO2↑+18H2O中草酸和高锰酸钾之间的关系式得,酸性高锰酸钾的物质的量浓度=$\frac{\frac{W}{63}}{V×1{0}^{-3}}×0.025×\frac{2}{5}$=$\frac{W}{6.3V}$mol/L,
故答案为:$\frac{W}{6.3V}$mol/L;
(6)在放置过程中,由于空气中还原性物质的作用,使KMnO4溶液的浓度变小了,再去滴定水样中的Fe2+时,需要消耗KMnO4溶液(标准溶液)的体积会增大,导致计算出来的c(Fe2+)值会增大,测定的结果偏高,故答案为:偏高.
点评 本题考查了滴定实验的应用,题目难度中等,明确滴定原理是解答本题的关键,注意基准试剂的选取方法,侧重于考查学生的实验探究能力和计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
| 序号 | 温度 | 0.1mol•L-1Na2S2O3溶液 | 0.1mol•L-1H2SO4溶液 | H2O | 达到相同程度所用的时间/s |
| ① | 25℃ | 25mL | 25mL | 0mL | 4 |
| ② | 25℃ | 25mL | 15mL | 10.0mL | 6 |
| ③ | 25℃ | V1 | 25mL | 10mL | 6 |
| ④ | 45℃ | V2 | 25mL | V3 | 2 |
(1)量取液体所用的仪器及规格是量筒,50mL.
(2)为测量某一物质达到某特点值所用的时间,最易测量的物质的是C.
A.Na2S2O3浓度 B.H2SO4的浓度 C.S单质的量 D.SO2的量
(3)实验①、②、③得出的结论是相同温度下,反应物浓度越大,反应速率越快,其中 V1=15mL.
(4)实验④时研究温度对化学反应速度的影响,则 V2=15mL,V3=10mL.
(5)为处理实验后的废液,实验小组向废液中加入少量的NaOH溶液至溶液呈微酸性,发现溶液变澄清,写出发生反应的化学方程式:6NaOH+3S=2Na2S+Na2SO3+3H2O.
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)温度相同时,同浓度的CH3COO-、HCO3-、CO32-、S2-的水解能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在CH3COONa溶液中在相关离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-→不能(填“能”或“不能”,下同) H2CO3+HS-→能.
| A. | 可用明矾和漂白粉处理自来水,二者的作用原理相同 | |
| B. | 室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| D. | 可用澄清的石灰水鉴别碳酸钠和碳酸氢钠 |
| A. |  分离NaCl、I2混合物 | B. |  干燥CO2气体 | ||
| C. |  稀释浓硫酸 | D. |  分离溴、CCl4混合物 |
| A. | 乙醇 | B. | 乙酸钠 | C. | 苯酚钠 | D. | 碳酸钠 |
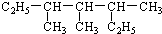 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷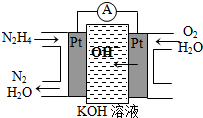 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题