题目内容
3.能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.(1)如图1所示,组成一个原电池.
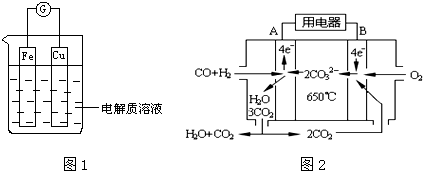
①当电解质溶液为稀硫酸时:Cu电极是正(填“正”或“负”)极,其电极反应为2H++2e-=H2↑;
②当电解质溶液为浓硝酸时:Cu电极是负极,其电极反应为Cu-2e-=Cu2+.
(2)请写出电解硫酸铜溶液的总化学方程式2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(3)燃烧氢气时耗氧量小,放出热量多.已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.6kJ•mol-1.
(4)图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出B极发生的电极反应式:O2+2CO2+4e-=2CO32-.
(5)请根据下面所给出的5个热化学方程式,判断反应④的反应热△H4是+16.3kJ•mol-1.
①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ•mol-1
②NH3(g)+H2O(l)═NH3•H2O(aq)△H2=-35.1kJ•mol-1
③HCl(g)+H2O(l)═HCl(aq)△H3=-72.3kJ•mol-1
④NH4Cl(s)+H2O(l)═NH4Cl(aq)△H4=?
⑤NH3•H2O(aq)+HCl(aq)═NH4Cl(aq)+H2O(l)△H5=-52.3kJ•mol-1.
分析 (1)在原电池中,易失电子的电极为负极,另一个电极为正极
①当电解质溶液为稀硫酸时,铁易失电子作负极、Cu作正极,正极上氢离子放电;
②当电解质溶液为浓硝酸时,铜易失电子作负极,负极上铜失电子生成铜离子;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;
(3)4g H2的物质的量是2mol,4g H2燃烧生成液态水时放热为571.6kJ,则1mol燃烧生成液态水时放热为285.8kJ;
(4)由图可知,B为正极,氧气得到电子;
(5)根据盖斯定律②-①+③+⑤得到NH4Cl(s)+H2O(l)═NH4Cl(aq)△H4.
解答 解:(1)①当电解质溶液为稀硫酸时,铁易失电子作负极、Cu作正极,正极上氢离子放电,Cu电极上电极反应式为2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;
②当电解质溶液为浓硝酸时,铁和浓硝酸发生钝化现象,所以铜易失电子作负极,负极上铜失电子生成铜离子,电极反应式为Cu-2e-=Cu2+,故答案为:负;Cu-2e-=Cu2+;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(3)4g H2的物质的量是2mol,4g H2燃烧生成液态水时放热为571.6kJ,则1mol燃烧生成液态水时放热为285.8kJ,则氢气的燃烧热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.6 kJ•mol-1,故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.6 kJ•mol-1;
(4)由图可知,B为正极,氧气得到电子,正极反应为O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
(5)①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ•mol-1
②NH3(g)+H2O(l)═NH3•H2O(aq)△H2=-35.1kJ•mol-1
③HCl(g)+H2O(l)═HCl(aq)△H3=-72.3kJ•mol-1
④NH4Cl(s)+H2O(l)═NH4Cl(aq)△H4=?
⑤NH3•H2O(aq)+HCl(aq)═NH4Cl(aq)+H2O(l)△H5=-52.3kJ•mol-1.
由盖斯定律 ②-①+③+⑤得到NH4Cl(s)+H2O(l)═NH4Cl(aq)△H4=△H2-△H1+△H3+△H5=+16.3kJ•mol-1,故答案为:+16.3kJ•mol-1.
点评 本题考查电解原理及应用,为高频考点,把握原电池、电解池的工作原理为解答的关键,侧重分析与应用能力的考查,注意(5)中利用盖斯定律计算,题目难度不大.

| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
| A. | “山东疫苗案”涉疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 半导体行业中有一句“行话”:“从沙滩到用户”,说明计算机芯片的主要成分是二氧化硅 | |
| D. | 自来水厂常用明矾作消毒杀菌剂 |
| A. | 按系统命名法 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 | |
| B. | 乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应 | |
| C. | 分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
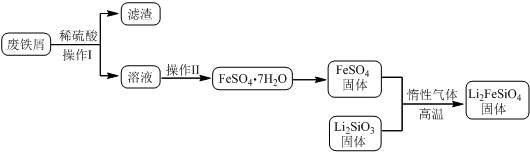
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
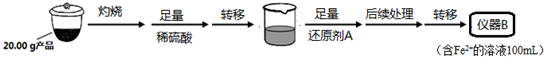
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是防止二价铁被氧化.
(3)操作Ⅱ的步骤蒸发浓缩,降温结晶,过滤,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需玻璃棒.
(4)还原剂A可用SO2,写出该反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续处理的主要目的是除去过量的SO2,以免影响后面Fe2+的测定.
(5)滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高.(填“偏高”、“偏低”或“不变”).
| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
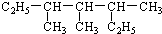 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷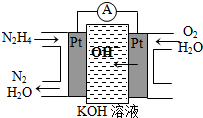 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题