题目内容
4.氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.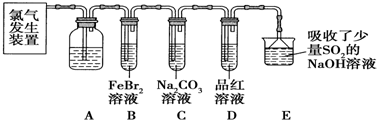
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有分液漏斗、酒精灯.
(2)装置A中盛有的试剂是:饱和食盐水,作用是:除去氯气中的氯化氢.
(3)若D中品红溶液褪色,则B装置发生反应的离子方程式是:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2.
(4)证明FeBr2与Cl2发生了(3)中氧化还原反应的实验方法是:实验后,取少量B中溶液,滴加KSCN溶液,溶液变血红色;另取少量B中溶液,加入CCl4溶液,振荡,静置,下层液体呈橙色 (填操作方法).
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设:
假设1:只存在SO32-; 假设2:只存在ClO-; 假设3:既不存在SO32-,也不存在ClO-.
(5)学习小组判断同时存在SO32-和ClO-是不可能的,理由是:SO32-和ClO-发生氧化还原反应.
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.
a.3mol•L-1 H2SO4 b.0.01mol•L-1 KMnO4 c.1mol•L-1 BaCl2溶液 d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加少量b (填序号),若溶液褪色(填现象),则假设1成立.
步骤三:向B试管中滴加少量d (填序号),若溶液变蓝色(填现象),则假设2成立.
分析 (1)二氧化锰和浓盐酸反应制取氯气加热需酒精灯,需要用分液漏斗加浓盐酸;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯化氢和氯气的溶解性选择合适的除杂剂;
(3)氯气具有强氧化性,能够溴化亚铁中的溴离子和二价铁离子,生成单质溴和三价铁离子;
(4)三价铁离子和硫氰酸钾溶液反应生成血红色溶液;生成的溴单质可以利用四氯化碳萃取的现象来分析发生了反应;
(5)亚硫酸根具有强的还原性,次氯酸根具有强的氧化性,二者混合会发生氧化还原反应;
(6)KMnO4 具有强氧化性,SO32-中+4价的硫具有还原性,二者能够发生氧化还原反应使高锰酸钾褪色;
ClO-具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝.
解答 解:(1)二氧化锰和浓盐酸反应制取氯气加热需酒精灯,需要用分液漏斗加浓盐酸;
故答案为:分液漏斗;酒精灯;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以用盛放饱和食盐水的A洗气瓶除去氯气中的氯化氢;
故答案为:饱和食盐水;除去氯气中的氯化氢;
(3)D中品红溶液褪色,B中通入足量的氯气,氯气具有强氧化性,足量的氯气与溴化亚铁反应生成氯化铁和溴,离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2,
故答案为:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2;
(4)要证明FeBr2与Cl2发生了氧化还原反应,只需分别证明三价铁离子和溴单质的存在,而三价铁离子和硫氰酸钾溶液反应生成血红色溶液,溴的四氯化碳显棕红色,所以操作方法为:实验后,取少量B中溶液,滴加KSCN溶液,溶液变血红色;另取少量B中溶液,加入CCl4溶液,振荡,静置,下层液体呈橙色;
故答案为:实验后,取少量B中溶液,滴加KSCN溶液,溶液变血红色;另取少量B中溶液,加入CCl4溶液,振荡,静置,下层液体呈橙色;
(5)亚硫酸根具有强的还原性,次氯酸根具有强的氧化性,二者混合会发生氧化还原反应;
故答案为:SO32-和ClO-因发生氧化还原反应;
(6)步骤二:酸性KMnO4溶液具有强的氧化性,能够氧化具有还原性的亚硫酸根离子,本身被还原,溶液褪色;
步骤三:ClO-具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;
故答案为:b;褪色;d;变蓝色.
点评 本题考查了氯气的性质和实验室制备,明确制取的原理以及氯气的性质等是解题关键,题目综合性强,难度较大.

| A. | 少量NaHCO3溶液与过量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3+2H2O+CO32- | |
| B. | 往碳酸钙中滴加稀盐酸:CO32-+2H+═CO2+H2O | |
| C. | 往氨水中滴加氯化铝:Al3++4OH-═AlO2-+2H2O | |
| D. | FeCl2溶液中滴加H2O2溶液:2Fe2++2H++H2O2═2Fe3++2H2O |
| 选项 | 实验目的 | 实验方案 |
| A | 验证二氧化硫漂白性 | 二氧化硫通入溴水中,看溶液颜色是否褪色 |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加氢氧化钠溶液 |
| C | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
| D | 验证Ksp(AgI)>Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液,观察沉淀颜色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Fe2+、Ca2+、Cl-、NO3- | B. | Na+、AlO2-、Cl-、SO42- | ||
| C. | K+、Ba2+、Cl-、NO3- | D. | Fe3+、Al3+、Cl-、SCN- |
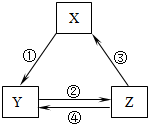 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z |
| A | CaO | Ca(OH)2 | CaCO3 |
| B | AlCl3 | NaAlO2 | Al(OH)3 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
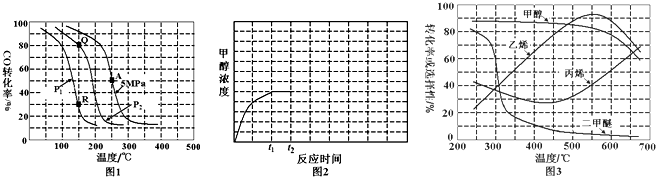
 开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题.甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题.甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示: