题目内容
13.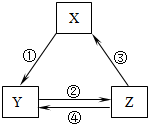 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z |
| A | CaO | Ca(OH)2 | CaCO3 |
| B | AlCl3 | NaAlO2 | Al(OH)3 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.CaCO3不能一步生成Ca(OH)2 ;
B.AlCl3与过量氢氧化钠反应生成NaAlO2,NaAlO2与弱酸反应生成Al(OH)3,Al(OH)3与盐酸反应生成AlCl3,Al(OH)3与氢氧化钠反应生成NaAlO2;
C.Fe2O3与盐酸反应生成FeCl3,FeCl3与氢氧化钠反应生成Fe(OH)3,Fe(OH)3受热分解得Fe2O3,Fe(OH)3与盐酸反应生成FeCl3;
D.FeCl3不能一步反应生成Fe;
解答 解:A.CaCO3不能一步生成Ca(OH)2 ,故A错误;
B.AlCl3与过量氢氧化钠反应生成NaAlO2,NaAlO2与弱酸反应生成Al(OH)3,Al(OH)3与盐酸反应生成AlCl3,Al(OH)3与氢氧化钠反应生成NaAlO2,故B正确;
C.Fe2O3与盐酸反应生成FeCl3,FeCl3与氢氧化钠反应生成Fe(OH)3,Fe(OH)3受热分解得Fe2O3,Fe(OH)3与盐酸反应生成FeCl3,故C正确;
D.FeCl3不能一步反应生成Fe,被还原先生成亚铁离子,进而生成Fe,故D错误;
故选AD.
点评 该题是中等难度的试题,试题设计新颖,基础性强,紧扣教材,侧重对学生基础知识的检验和训练,同时坚固对学生能力的培养,有利于激发学生的学习积极性,提高学生灵活运用基础知识解决实际问题的能力

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 用广泛pH试纸测得氯水的pH=5.2 | |
| B. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| C. | 在氧化还原反应中,还原剂得到电子总数等于氧化剂失去电子的总数 | |
| D. | Mg在CO2中燃烧生成MgO和C.在该反应条件下,Mg的还原性强于C的 |
8. 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.
(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为69.15kJ.
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1>K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”).
②见右图,T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=0.09mol/(L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡向右移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,在一定压强下测得如下数据:
①则该反应△H>0,表中数据a<d,b<f(均选填“>”、“=”或“<”).
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?净化后重新充入合成塔内,循环利用,提高原料利用率.
 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为69.15kJ.
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1>K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”).
②见右图,T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=0.09mol/(L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡向右移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,在一定压强下测得如下数据:
| 温度/℃ CO2转化率% $\frac{n(N{H}_{3})}{n(C{O}_{2})}$ | 100 | 150 | 200 |
| 1 | 19.6 | 27.1 | 36.6 |
| 1.5 | a | b | c |
| 2 | d | e | f |
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?净化后重新充入合成塔内,循环利用,提高原料利用率.
5.下列说法正确的是( )
| A. | 在101kPa下氢气的燃烧热△H=-285.5kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| C. | 一定温度下,1L0.50mol/LNH4Cl溶液与2L0.25NH4Cl溶液含NH4+物质的是不同 | |
| D. | 吸热反应“TiO2(g)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
2.高铁酸钠(Na2FeO4)可用于城市自来水处理.下列相关分析正确的是( )
| A. | Na2FeO4溶液显强碱性,能消毒杀菌 | |
| B. | Na2FeO4具有强氧化性,能消毒杀菌 | |
| C. | Na2FeO4的氧化产物Fe3+易水解为Fe(OH)3,可以净水 | |
| D. | Na2FeO4的还原产物Fe2+易水解为Fe(OH)2,可以净水 |
3.下列反应的离子方程式中,书写正确的是( )
| A. | 实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32-═CO2↑+H2O | |
| B. | 氯化铝中加入氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 硫酸铜与氢氧化钡溶液反应:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
 硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.
硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.