题目内容
12.下列化学反应的离子方程式正确的是( )| A. | 少量NaHCO3溶液与过量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3+2H2O+CO32- | |
| B. | 往碳酸钙中滴加稀盐酸:CO32-+2H+═CO2+H2O | |
| C. | 往氨水中滴加氯化铝:Al3++4OH-═AlO2-+2H2O | |
| D. | FeCl2溶液中滴加H2O2溶液:2Fe2++2H++H2O2═2Fe3++2H2O |
分析 A.NaHCO3完全反应,生成碳酸钙、水、NaOH;
B.碳酸钙在离子反应中保留化学式;
C.反应生成氢氧化铝和氯化铵;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.少量NaHCO3溶液与过量澄清石灰水的离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,故A错误;
B.往碳酸钙中滴加稀盐酸的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C.往氨水中滴加氯化铝的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故C错误;
D.FeCl2溶液中滴加H2O2溶液的离子反应为2Fe2++2H++H2O2═2Fe3++2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
3.下列说法正确的是( )
| A. | 用广泛pH试纸测得氯水的pH=5.2 | |
| B. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| C. | 在氧化还原反应中,还原剂得到电子总数等于氧化剂失去电子的总数 | |
| D. | Mg在CO2中燃烧生成MgO和C.在该反应条件下,Mg的还原性强于C的 |
20.中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示:下列叙述正确的( )
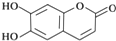

| A. | M的分子式是C9H6O4 | |
| B. | 1molM最多能与2molBr2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1molM与足量NaHCO3反应能生成2molCO2 |
7.钠长时间放在空气中,最后的产物主要成分是( )
| A. | Na2O | B. | NaOH | C. | Na2CO3 | D. | Na2CO3•10H2O |
17.下列离子方程式不正确的是( )
| A. | NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+═CaSO3↓ | |
| C. | NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
2.高铁酸钠(Na2FeO4)可用于城市自来水处理.下列相关分析正确的是( )
| A. | Na2FeO4溶液显强碱性,能消毒杀菌 | |
| B. | Na2FeO4具有强氧化性,能消毒杀菌 | |
| C. | Na2FeO4的氧化产物Fe3+易水解为Fe(OH)3,可以净水 | |
| D. | Na2FeO4的还原产物Fe2+易水解为Fe(OH)2,可以净水 |
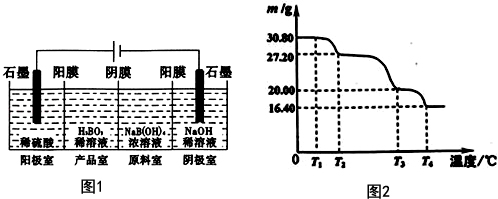 硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.
硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.