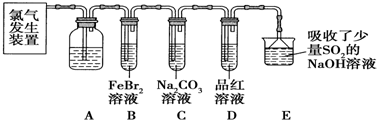
题目内容
19.现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种.(已知Al(OH)3具有两性,既可与强酸反应,又可与强碱反应Al(OH)3+NaOH═Na[Al(OH)4]、CO32-与Al3+或Fe3+在水溶液中不能共存,会相互反应产生相应氢氧化物沉淀及CO2气体等)(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是Na2CO3和Ba(OH)2(填化学式,且相对分子质量最小的写在第一个空);
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质为记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解.则:X为B;
A.SO3- B.SO42- C.CH3COO- D.SiO32-
(3)向B的水溶液中逐滴加入盐酸且边加边振荡,发现基本没有气泡,原因是CO32-+H+=HCO3-(用离子方程式表示);
(4)将0.02mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为6.09g(保留两位小数).
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.则物质D一定含有上述离子中的NO3-(填相应的离子符号).有关反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(6)利用上述已经确定的物质,可以检验出D中的阳离子.请简述实验操作步骤、现象及结论取少量D的溶液与试管中,逐渐进入Ba(OH)2溶液至过量,先出现白色沉淀后溶解,则D中含有Al3+,若生成的白色沉淀不溶解,则D中含有Mg2+.
分析 (1)根据离子之间结合生成沉淀,不能共存,确定含有的两种物质;
(2)C与B的溶液混合时,产生红褐色沉淀和无色无味气体,沉淀为氢氧化铁、气体为二氧化碳;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则B为Na2CO3,A为Ba(OH)2,C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝.
(3)由上面推断可知B为Na2CO3,碳酸根可与氢离子结合生成碳酸氢根;
(4)已知C为Fe2(SO4)3,A为Ba(OH)2,将0.02molA与0.01molC同时溶解在足量的蒸馏水中,反应生成碳酸钡沉淀和氢氧化铁沉淀,根据反应方程中的关系求出沉淀的量;
(5)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,该气体为NO2,说明D中含有NO3-;
(6)D中含有NO3-,则E中含有Cl-,剩余Al3+、Mg2+,利用氢氧化铝溶液强碱的性质检验.
解答 解:(1)因Al3+、Mg2+、Fe3+和OH-反应生成沉淀,Al3+、Mg2+、Ba2+、Fe3+和CO32-反应,则不能共存,所以一定存在的物质为Na2CO3 和 Ba(OH)2,
故答案为:Na2CO3;Ba(OH)2;
(2)C与B的溶液混合时,产生红褐色沉淀和无色无味气体,沉淀为氢氧化铁、气体为二氧化碳;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则B为Na2CO3,A为Ba(OH)2,C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝,因C为Fe2(SO4)3酸铁,则阴离子有SO42-,则X为SO42-,
故答案为:B;
(3)由上面推断可知B为Na2CO3,碳酸根可与氢离子结合生成碳酸氢根:CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
(4)已知C为Fe2(SO4)3,A为Ba(OH)2,将0.02molA与0.01molC同时溶解在足量的蒸馏水中,反应生成碳酸钡沉淀和氢氧化铁沉淀,Fe2(SO4)3+3Ba(OH)2═2Fe(OH)3↓+3BaSO4↓,
根据方程可知,硫酸铁过量,按照Ba(OH)2计算,
则n(BaSO4)=0.02mol,n(Fe(OH)3)=$\frac{2}{3}$×0.02mol,
所以沉淀的质量为m(BaSO4)+m(Fe(OH)3)=0.02mol×233g/mol+$\frac{2}{3}$×0.02mol×107g/mol=6.09g
故答案为:6.09g;
(5)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,该气体为NO2,说明D中含有NO3-,反应离子方程式为:3Cu+8H++2NO3-═3Cu2+2NO↑+4H2O,
故答案为:NO3-;3Cu+8H++2NO3-═3Cu2+2NO↑+4H2O;
(6)D中含有NO3-,则E中含有Cl-,剩余Al3+、Mg2+,Al(OH)3能溶于过量Ba(OH)2溶液,检验方案为:取少量D的溶液与试管中,逐渐进入Ba(OH)2溶液至过量,先出现白色沉淀后溶解,则D中含有Al3+,若生成的白色沉淀不溶解,则D中含有Mg2+,
故答案为:取少量D的溶液与试管中,逐渐进入Ba(OH)2溶液至过量,先出现白色沉淀后溶解,则D中含有Al3+,若生成的白色沉淀不溶解,则D中含有Mg2+.
点评 本题考查离子推断、实验方案设计等,是对所学知识的综合考查,题目难度较大,综合度较高,旨在考查学生的推断能力与方案设计能力,注意根据反应现象进行推断.

| A. | 放电过程中电解质溶液中阴离子移向正极 | |
| B. | 放电时每转移0.5mol电子,负极有0.5molV2+被氧化 | |
| C. | 充电时阳极附近溶液的酸性减弱 | |
| D. | 充电时阳极反应式为:VO2++2H++e-═VO2++H2O |
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟Ca(OH)2溶液反应得到白色沉淀
③钠在常温下不容易被氧化,加热下被氧化成白色固体
④Na2O2可作供氧剂,而Na2O不行
⑤Na2CO3溶液和NaHCO3溶液都呈碱性.
| A. | 都正确 | B. | ②③④⑤ | C. | ②③⑤ | D. | ②④⑤ |
| A. | Na2O | B. | NaOH | C. | Na2CO3 | D. | Na2CO3•10H2O |
| A. | 化石燃料属于可再生能源,不影响可持续发展 | |
| B. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 氢气燃烧热高,其燃烧产物是水,是一种理想的清洁燃料 |
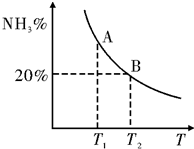 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为69.15kJ.
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1>K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”).
②见右图,T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=0.09mol/(L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡向右移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,在一定压强下测得如下数据:
| 温度/℃ CO2转化率% $\frac{n(N{H}_{3})}{n(C{O}_{2})}$ | 100 | 150 | 200 |
| 1 | 19.6 | 27.1 | 36.6 |
| 1.5 | a | b | c |
| 2 | d | e | f |
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?净化后重新充入合成塔内,循环利用,提高原料利用率.
| A. | 离子晶体中,只存在离子键,不可能存在其它化学键 | |
| B. | 氧族元素(O、S、Se、Te)的氢化物的沸点依次升高 | |
| C. | NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:1 | |
| D. | 晶体的硬度:金刚石>碳化硅>石英 |