题目内容
14.下列溶液中有关微粒的物质的量浓度关系正确的是( )| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
分析 A.根据溶液中的电荷守恒来回答;
B.醋酸钠和盐酸反应生成氯化钠和醋酸,恰好反应时,溶液显示酸性,根据中性溶液中,氢离子和氢氧根的浓度相等来回答;
C.根据铵根离子的水解受其他离子的影响情况来回答;
D.次氯酸根离子易水解,氯离子不水解,根据电荷守恒分析.
解答 解:A.电荷守恒等式为:c(H+)+c(Na+)=c(OH-)+c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-),溶液呈中性,c(H+)=c(OH-),导出c(Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-),S和C均用R表示,应为c(Na+)=c(HRO3-)+2c(RO32-),故A正确;
B.电荷守恒式为:c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-),溶液呈中性,c(H+)=c(OH-),导出c(Na+)=c(Cl-)+c(CH3COO-);根据物料守恒有c(Na+)=c(CH3COOH)+c(CH3COO-),由此二式导出c(Cl-)=c(CH3COOH),综上所述,有c(Na+)>c(Cl-)=c(CH3COOH),故B错误;
C.NH4+水解呈酸性,CO32-水解呈碱性,它促进NH4+的水解;Fe2+水解呈酸性,它抑制NH4+的水解,所以三种溶液中c(NH4+):③>②>①,故C错误;
D.溶液中存在电荷守恒c(Na+)+c(H+)=c(ClO-)+c(OH-),c(Na+)+c(H+)=c(Cl-)+c(OH-),由于NaClO水解显碱性,因此有c(H+)NaClO<c(H+)NaCl,所以离子总数多少:N前<N后,故D错误;
故选A.
点评 本题考查离子浓度大小比较,题目难度中等,本题注意从溶液中的电荷守恒、物料守恒等角度分析,在此类题目中经常用到,做题时注意体会,也是易错点.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案| A. | 在101kPa下氢气的燃烧热△H=-285.5kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| C. | 一定温度下,1L0.50mol/LNH4Cl溶液与2L0.25NH4Cl溶液含NH4+物质的是不同 | |
| D. | 吸热反应“TiO2(g)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
| A. | Na2FeO4溶液显强碱性,能消毒杀菌 | |
| B. | Na2FeO4具有强氧化性,能消毒杀菌 | |
| C. | Na2FeO4的氧化产物Fe3+易水解为Fe(OH)3,可以净水 | |
| D. | Na2FeO4的还原产物Fe2+易水解为Fe(OH)2,可以净水 |
| A. | 离子晶体中,只存在离子键,不可能存在其它化学键 | |
| B. | 氧族元素(O、S、Se、Te)的氢化物的沸点依次升高 | |
| C. | NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:1 | |
| D. | 晶体的硬度:金刚石>碳化硅>石英 |
| A. | 实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32-═CO2↑+H2O | |
| B. | 氯化铝中加入氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 硫酸铜与氢氧化钡溶液反应:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
| A. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| B. | 点燃爆竹后,硫燃烧生产SO3 | |
| C. | 海水中含有溴元素,只进行物理变化就可以得到溴单质 | |
| D. | “地沟油”禁止使用,但可以用来制取肥皂 |
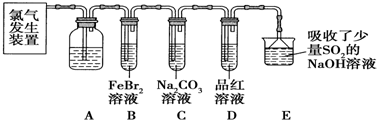
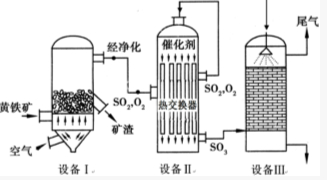 以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.