题目内容
16.在强酸性溶液中,下列各组离子能够大量共存的是( )| A. | Fe2+、Ca2+、Cl-、NO3- | B. | Na+、AlO2-、Cl-、SO42- | ||
| C. | K+、Ba2+、Cl-、NO3- | D. | Fe3+、Al3+、Cl-、SCN- |
分析 强酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.酸溶液中不能大量存在AlO2-,故B错误;
C.酸溶液中该组离子之间不反应,可大量共存,故C正确;
D.Fe3+、SCN-结合生成络离子,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、络合反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
6.欲除去铁粉中少量的铝粉,可选用的试剂是( )
| A. | 水 | B. | 氢氧化钠溶液 | C. | 稀硫酸 | D. | 稀硝酸 |
7.钠长时间放在空气中,最后的产物主要成分是( )
| A. | Na2O | B. | NaOH | C. | Na2CO3 | D. | Na2CO3•10H2O |
11.下列关于能源的说法错误的是( )
| A. | 化石燃料属于可再生能源,不影响可持续发展 | |
| B. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 氢气燃烧热高,其燃烧产物是水,是一种理想的清洁燃料 |
8. 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.
(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为69.15kJ.
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1>K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”).
②见右图,T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=0.09mol/(L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡向右移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,在一定压强下测得如下数据:
①则该反应△H>0,表中数据a<d,b<f(均选填“>”、“=”或“<”).
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?净化后重新充入合成塔内,循环利用,提高原料利用率.
 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为69.15kJ.
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1>K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”).
②见右图,T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=0.09mol/(L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡向右移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,在一定压强下测得如下数据:
| 温度/℃ CO2转化率% $\frac{n(N{H}_{3})}{n(C{O}_{2})}$ | 100 | 150 | 200 |
| 1 | 19.6 | 27.1 | 36.6 |
| 1.5 | a | b | c |
| 2 | d | e | f |
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?净化后重新充入合成塔内,循环利用,提高原料利用率.
5.下列说法正确的是( )
| A. | 在101kPa下氢气的燃烧热△H=-285.5kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| C. | 一定温度下,1L0.50mol/LNH4Cl溶液与2L0.25NH4Cl溶液含NH4+物质的是不同 | |
| D. | 吸热反应“TiO2(g)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
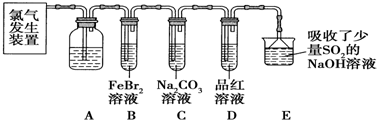
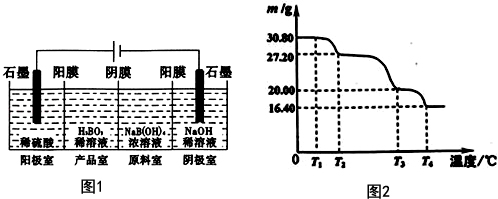 硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.
硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.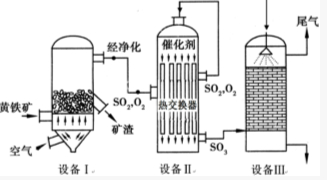 以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.