题目内容
11.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
分析 (1)依据热化学方程式和盖斯定律计算得到NO(g)与CO(g)反应的热化学方程式;\
(2)①相同条件下,气体的物质的量之比等于其压强之比;
2N2O5(g)═4NO2(g)+O2(g)
开始(mol/L)1.00 0 0
反应(mol/L)0.65 1.30 0.325
3min(mol/L)0.35 1.30 0.325
反应前后气体的压强之比等于其物质的量之比;
先计算五氧化二氮的反应速率,再根据同一时间段内各物质的反应速率之比等于其计量数之比计算氧气反应速率;
②a.容器中压强不再变化,反应已达到化学平衡状态,故a正确;
b.NO2和O2的体积比始终都不变,不能确定反应是否达到化学平衡状态,故b错误;
c.υ正(NO2)=2υ逆(N2O5)才表明达到化学平衡状态,故c错误;
d.平衡时,气体的平均相对分子质量为大于43.2,且保持不变.故d错误.
(3)化学平衡常数K=$\frac{生成物分压幂之积}{反应物分压幂之积}$;
(4)根据电荷守恒及电离常数进行计算.
解答 解:(1)①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
依据盖斯定律计算③×2-①-②得到热化学方程式 2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1 ,
故答案为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1;
(2)①相同条件下,气体的物质的量之比等于其压强之比;
2N2O5(g)═4NO2(g)+O2(g)
开始(mol/L)1.00 0 0
反应(mol/L)0.65 1.30 0.325
3min(mol/L)0.35 1.30 0.325
反应前后气体的压强之比等于其物质的量之比,所以p:p0=(0.35+1.30+0.325)mol:1.00mol=1.975;
v(N2O5)=$\frac{0.50-0.17}{3}$mol/(L.min)=0.11mol/(L.min),再根据同一时间段内各物质的反应速率之比等于其计量数之比得氧气反应速率为0.055 mol•L-1•min-1,
故答案为:1.975;0.055 mol•L-1•min-1;
②a.容器中压强不再变化,反应已达到化学平衡状态,故a正确;
b.NO2和O2的体积比始终都不变,不能确定反应是否达到化学平衡状态,故b错误;
c.υ正(NO2)=2υ逆(N2O5)才表明达到化学平衡状态,故c错误;
d.平衡时,气体的平均相对分子质量为大于43.2,且保持不变.故d错误.
故答案为:a;
(3)化学平衡常数K=$\frac{生成物分压幂之积}{反应物分压幂之积}$;
四氧化二氮的转化率是0.4,设原来四氧化二氮的物质的量为xmol,N2O4转化物质的量0.4xmol,NO2生成的物质的量为0.8xmol,则混合气体的物质的量=(x-0.4x+0.8x)mol=1.4xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=$\frac{200KPa}{{P}_{2}}$=$\frac{x}{1.4x}$,所以P2=280KPa,
四氧化二氮的分压=280KPa×$\frac{0.6xmol}{1.4xmol}$=120KPa,
二氧化氮的分压=280KPa×$\frac{0.8x}{1.4x}$=160KPa,
化学平衡常数K=$\frac{生成物分压幂之积}{反应物分压幂之积}$=$\frac{16{0}^{2}}{120}$=213.3KPa,
故答案为:213.3KPa;
(4)由电荷守恒式c(Na+)+c(H+)=c(OH-)+c(N3-)和B点时溶液的pH=7得:c(Na+)=c(N3-)
设氢氧化钠的物质的量为xmol
依据HN3?H++N3-的电离平衡:K=1×10-5=$\frac{c({H}^{+})•c({N}_{3}^{-})}{c(H{N}_{3})}$=$\frac{1{0}^{-7}×x}{0.1-x}$
解得:x=0.099mol
故答案为:0.099.
点评 本题考查化学平衡有关计算,为高频考点,涉及平衡计算、盖斯定律等知识点,侧重考查学生分析计算及获取信息解答问题能力,难点是(3)题平衡常数的计算,注意分压的计算方法,题目难度较大.

①加H2O
②加NaOH固体
③加CH3COONa固体
④加Na2CO3固体
⑤加入NaNO3固体
⑥加NaCl溶液
⑦滴入几滴硫酸铜溶液
⑧升高温度
⑨将块状铁改为铁粉
⑩将稀硫酸改用98%的浓硫酸.
| A. | ⑧⑨⑩ | B. | ⑦⑧⑨ | C. | ③⑦⑩ | D. | ⑦⑧⑩ |
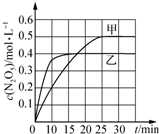 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物 | |||
| 起始量 | 2mol NO2 | ||
| 1mol O3 | 2mol NO2 | ||
| 1mol O3 | 2mol N2O5 | ||
| 1mol O2 | |||
| 温度/K | T1 | T2 | T2 |
| A. | 0~10 min内甲容器中反应的平均速率:v(NO2)=0.02 mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1K时,若起始时向容器甲中充入2 mol NO2、1 mol O3、2 mol N2O5和2 mol O2,则脱硝反应达到平衡前,v(正)<v(逆) |
用CO和H2制甲醇的反应:CO(g)+2H2(g)?CH3OH (g)△H=-99kJ•mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
(2)在容积为1L的恒容容器中,分别研究在T1、T2、T3三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率α(CO)的关系如图1所示:
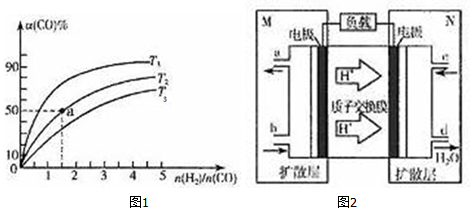
①T1、T2、T3中,温度最高的是T3.
②利用图中a点对应的数据,计算该反应在T2温度下的平衡常数K=4L2•mol-2.
若改变条件c(填序号),可使K=6L2•mol-2,
a.增大压强 b增大反应物的浓度
c.降低温度 d.减小$\frac{n({H}_{2})}{n(CO)}$
(3)用甲醇作燃料电池,其工作原理如图2所示.
①M区发生反应的电极反应式CH3OH+H2O-6e-=CO2+6H+.
②维持电流强度为0.5A,电池工作10分钟,理论上消耗甲醇$\frac{0.5×600}{96500×6}×32$g.(已知F=96500C•mol-1,写出计算表达式即可)
CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO)/mol | n (H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
(1)反应在t1min内的平均速率为v(H2)=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.4mol.
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应(填“放热”或“吸热”).
(4)700℃时,向容积为2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正)>v(逆)(填“>”、“<”或“=”).
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸汽的量(写出两种).
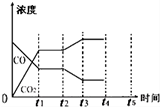
(6)若该容器绝热体积不变,不能判断反应达到平衡的是②③.
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化⑥v(CO2)正=v(H2O)逆.
| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
(1)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-245.6kJ/mol,化学平衡常数的表达式K=K=K12.K2.K3
(2)普通工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动.
(3)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,
其CO的平衡转化率随温度、压强变化关系如图所示:
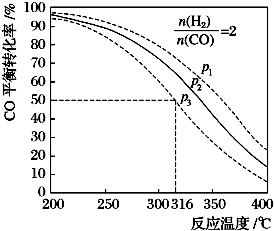
则该反应的△H<0(填“>”或“<”或“=”),在P3和316℃反应达到平衡时,H2的转化率等于50%,图中压强的大小关系为P1>P2>P3,理由是增大压强平衡正向移动CO转化率增大.
(4)以二甲醚(CH3OCH3)为原料设计电池,一个电极通入空气,另一个电极通入二甲醚蒸气,KOH溶液为电解质,则该电池的负极反应式为CH3OCH3-12e-+16OH -=2CO32-+11H2O .