题目内容
16.甲醇(CH3OH)是重要的基础有机原料.用CO和H2制甲醇的反应:CO(g)+2H2(g)?CH3OH (g)△H=-99kJ•mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
(2)在容积为1L的恒容容器中,分别研究在T1、T2、T3三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率α(CO)的关系如图1所示:
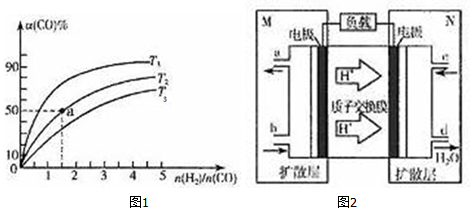
①T1、T2、T3中,温度最高的是T3.
②利用图中a点对应的数据,计算该反应在T2温度下的平衡常数K=4L2•mol-2.
若改变条件c(填序号),可使K=6L2•mol-2,
a.增大压强 b增大反应物的浓度
c.降低温度 d.减小$\frac{n({H}_{2})}{n(CO)}$
(3)用甲醇作燃料电池,其工作原理如图2所示.
①M区发生反应的电极反应式CH3OH+H2O-6e-=CO2+6H+.
②维持电流强度为0.5A,电池工作10分钟,理论上消耗甲醇$\frac{0.5×600}{96500×6}×32$g.(已知F=96500C•mol-1,写出计算表达式即可)
分析 (1)化学反应的焓变=反应物键能总和-生成物键能总和;
(2)①反应是放热反应,升高温度平衡逆向移动;
②a点时CO的转化率为50%,可计算各物质的浓度,以此解答平衡常数;化学平衡常数只与温度有关,要改变化学平衡常数只能改变温度;
(3)①原电池工作时,阳离子向正极移动,由氢离子的移动方向可知M为负极,N为正极,负极上甲醇失电子生成二氧化碳和氢离子;
②电流强度为0.5A,电池工作10min,则电量为0.5A×600s=300C,转移电子的物质的量为$\frac{300C}{96500C/mol}$,根据甲醇和转移电子之间的关系式计算甲醇质量.
解答 解:(1)CO(g)+2H2(g)?CH3OH (g)△H=-99kJ•mol-1,△H=x+2a-(3d+b+c)=-99,x=b+c+3d-2a-99,
故答案为:b+c+3d-2a-99;
(2)①反应是放热反应,图象分析可是CO转化率随温度升高减小,则T3转化率最小,温度应最高,
故答案为:T3;
②a点时CO的转化率为50%,则CO(g)+2H2(g)?CH3OH
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡 (mol/L) 0.5 0.5 0.5
化学平衡常数K=$\frac{0.5}{0.5×0.{5}^{2}}$=4,
化学平衡常数只与温度有关,该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,要是平衡常数增大,应该降低温度,
故答案为:4;c;
(3)①原电池工作时,阳离子向正极移动,由氢离子的移动方向可知M为负极,N为正极,负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+,
故答案为:CH3OH+H2O-6e-=CO2+6H+;
②电流强度为0.5A,电池工作10min,则电量为0.5A×600s,转移电子的物质的量为$\frac{0.5A×600s}{96500C/mol}$,根据甲醇和转移电子之间的关系式得甲醇质量=$\frac{\frac{300C}{96500C/mol}}{6}×32g/mol$ $\frac{\frac{0.5A×600s}{96500C/mol}}{6}×32g/mol$=$\frac{0.5×600}{96500×6}×32$g,
故答案为:$\frac{0.5×600}{96500×6}×32$.
点评 本题考查化学平衡计算、外界条件对化学平衡移动影响、原电池原理等知识点,侧重考查学生分析计算及知识灵活应用能力,注意:化学平衡常数只与温度有关,与浓度、压强都无关,题目难度不大.

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
| A. | 加催化剂同时升高温度 | B. | 升高温度同时充入N2 | ||
| C. | 加催化剂同时增大压强 | D. | 降低温度同时减小压强 |
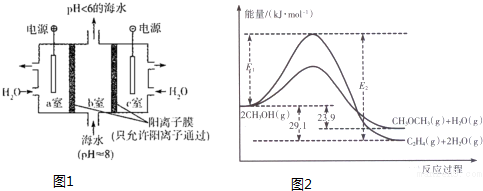
(1)溶于海水的CO2有4种存在形式.其中HCO3-占95%,除上述两种形式外,碳的存在形式还有H2CO3、CO32- (填微粒符号);利用图1装置进行的实验中,a室的电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑.
(2)下列为合成甲醇的有关化学方程式
①2H2(g)+CO(g)?CH3OH(g)
②H2(g)+CO2(g)?H2O(g)+CO(g)
③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为5.0.
(3)一定条件下,甲醇可同时发生:
A.2CH3OH(g)═CH3OCH3+H2O(g)
B.2CH3OH(g)═C2H4(g)+2H2O(g).
上述反应过程中能量变化如图2所示:
①写出反应速率较大的序号并说明原因A;该反应的活化能较小,在相同条件下反应速率较大.
②若在容器中加入催化剂,则E2-E1将不变〔填“变大”、“不变”或“变小”〕.
(4)一定温度时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,发生反应2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol,测得达平衡时的有关数据如下表:
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
②在温度不变、恒容条件下,该反应的平衡常数数值Kp=4.80×10-2,若甲容器中反应达平衡状态时,p(CH3OH)=24.0kPa,则平衡时,混合气体中CH3OH的物质的量分数为61.5% (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数).
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H1=-a kJ•mol-1.
已知:H2O(l)═H2O(g)△H2=+b kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-c kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-(a+3b-2c)kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O(g)?CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
②T℃时,向2L密闭容器中投入2.00molCH4和2.00mol H2O(g),5小时后测得反应体系达到平衡状态,此时c(CH4)=0.333mol•L-1,则T=1100℃,该温度下达到平衡时H2的平均生成速率为0.400mol/(L•h)(保留3位有效数字).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
用CxHy(烃)催化还原NOx可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式:CH4+2NO2 $\stackrel{催化剂}{→}$N2+CO2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.
固体电解质里O2-的移动方向是向负极(填“正极”或“负极”)移动,该电池负极的电极反应式为C2H6O+6O2--12e-=2CO2+3H2O.
| A. | F-的原子结构示意图: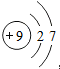 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |