题目内容
11.下列说法正确的一组是( )①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中加入少量KCl固体,溶液颜色变浅
③反应4A (g)+B(g)═2C(g)+D(g)不能自发进行,则该反应△H一定小于0
④活化分子之间的碰撞都是有效碰撞,都能引发化学反应
⑤熔融的电解质都能导电
⑥勒夏特列原理用于判断可逆反应是否达到平衡状态.
⑦合成氨的反应达到平衡后,给体系加压(压缩),活化分子数增加,所以反应速率加快.
| A. | ①③⑤⑥ | B. | ②④⑤⑦ | C. | 只有⑤ | D. | 均不对 |
分析 ①电解质的强弱和物质的溶解性之间没有必然的联系;
②FeCl3+3KSCN?Fe(SCN)3+3KCl平衡的移动和氯离子浓度之间没有关系;
③根据反应自发进行的判据△H-T△S<0来判断;
④活化分子之间的碰撞不一定为有效碰撞,要有一定的取向;
⑤熔融的电解质都能导电
⑥勒夏特列原理用于判断可逆反应是否达到平衡状态.
⑦给体系加压(压缩),活化分子百分数不变.
解答 解:①电解质的强弱和物质的溶解性之间没有必然的联系,不溶于水的盐(CaCO3、BaSO4等)在熔融状态下都完全电离,都是强电解质,故错误;
②FeCl3+3KSCN?Fe(SCN)3+3KCl平衡的移动和氯离子浓度之间没有关系,加入少量KCl固体,溶液颜色不变,故错误;
③反应自发进行的判据△H-T△S<0,反应4A (g)+B(g)═2C(g)+D(g)△S<0,反应不能自发进行,△H大于零时,低温下不自发,故错误;
④活化分子之间的碰撞不一定为有效碰撞,当发生化学反应的碰撞才是有效碰撞,故错误;
⑤熔融的电解质不一定都能导电,如HCl在熔融状态下不导电,故错误;
⑥勒夏特列原理用于判断可逆反应达到平衡状态在外界条件的改变下是否会发生移动,故错误;
⑦给体系加压(压缩),活化分子百分数不变,但浓度增大,反应速率增大,故错误;
故选D.
点评 本题考查综合考查化学平衡的影响因素、强弱电解质的概念,为高频考点,侧重于双基的考查,题目难度不大.

练习册系列答案
相关题目
1.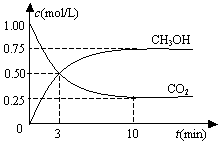 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
| A. | 反应进行到3 min时,该反应达到平衡状态 | |
| B. | 从反应开始到平衡,CO2的转化率为25% | |
| C. | 第3 min时,氢气的平均反应速率为1.5mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
19.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 升高温度同时充入N2 | ||
| C. | 加催化剂同时增大压强 | D. | 降低温度同时减小压强 |
6.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中的碳原子有sp3和sp2两种杂化类型 | |
| C. | 丙烯分子的所有原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
4.增强环保意识.爱护环境是每个公民的职责.利用碳的氧化物合成甲醇等资源化利用对环境保护具有重要意义.请回答下列问题:
(1)溶于海水的CO2有4种存在形式.其中HCO3-占95%,除上述两种形式外,碳的存在形式还有H2CO3、CO32- (填微粒符号);利用图1装置进行的实验中,a室的电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑.
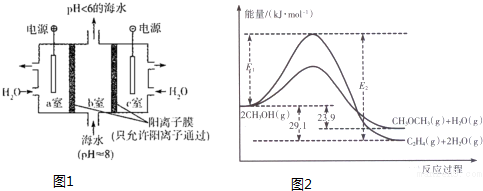
(2)下列为合成甲醇的有关化学方程式
①2H2(g)+CO(g)?CH3OH(g)
②H2(g)+CO2(g)?H2O(g)+CO(g)
③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为5.0.
(3)一定条件下,甲醇可同时发生:
A.2CH3OH(g)═CH3OCH3+H2O(g)
B.2CH3OH(g)═C2H4(g)+2H2O(g).
上述反应过程中能量变化如图2所示:
①写出反应速率较大的序号并说明原因A;该反应的活化能较小,在相同条件下反应速率较大.
②若在容器中加入催化剂,则E2-E1将不变〔填“变大”、“不变”或“变小”〕.
(4)一定温度时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,发生反应2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol,测得达平衡时的有关数据如下表:
①表中数据存在的关系为:|Q1|+|Q2|=90(填>、=或<,下同).2c2<c3.
②在温度不变、恒容条件下,该反应的平衡常数数值Kp=4.80×10-2,若甲容器中反应达平衡状态时,p(CH3OH)=24.0kPa,则平衡时,混合气体中CH3OH的物质的量分数为61.5% (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数).
(1)溶于海水的CO2有4种存在形式.其中HCO3-占95%,除上述两种形式外,碳的存在形式还有H2CO3、CO32- (填微粒符号);利用图1装置进行的实验中,a室的电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑.

(2)下列为合成甲醇的有关化学方程式
①2H2(g)+CO(g)?CH3OH(g)
②H2(g)+CO2(g)?H2O(g)+CO(g)
③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为5.0.
(3)一定条件下,甲醇可同时发生:
A.2CH3OH(g)═CH3OCH3+H2O(g)
B.2CH3OH(g)═C2H4(g)+2H2O(g).
上述反应过程中能量变化如图2所示:
①写出反应速率较大的序号并说明原因A;该反应的活化能较小,在相同条件下反应速率较大.
②若在容器中加入催化剂,则E2-E1将不变〔填“变大”、“不变”或“变小”〕.
(4)一定温度时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,发生反应2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol,测得达平衡时的有关数据如下表:
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
②在温度不变、恒容条件下,该反应的平衡常数数值Kp=4.80×10-2,若甲容器中反应达平衡状态时,p(CH3OH)=24.0kPa,则平衡时,混合气体中CH3OH的物质的量分数为61.5% (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数).
11.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
①反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=1.975;2.00min~5.00min内,O2的平均反应速率为0.055mol•L-1•min-1.
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
8.乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H1=-a kJ•mol-1.
已知:H2O(l)═H2O(g)△H2=+b kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-c kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-(a+3b-2c)kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O(g)?CO+3H2,该反应在不同温度下的化学平衡常数如表:
①反应是吸热反应(填“吸热”或“放热”);
②T℃时,向2L密闭容器中投入2.00molCH4和2.00mol H2O(g),5小时后测得反应体系达到平衡状态,此时c(CH4)=0.333mol•L-1,则T=1100℃,该温度下达到平衡时H2的平均生成速率为0.400mol/(L•h)(保留3位有效数字).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
用CxHy(烃)催化还原NOx可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式:CH4+2NO2 $\stackrel{催化剂}{→}$N2+CO2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.
固体电解质里O2-的移动方向是向负极(填“正极”或“负极”)移动,该电池负极的电极反应式为C2H6O+6O2--12e-=2CO2+3H2O.
2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H1=-a kJ•mol-1.
已知:H2O(l)═H2O(g)△H2=+b kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-c kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-(a+3b-2c)kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O(g)?CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
②T℃时,向2L密闭容器中投入2.00molCH4和2.00mol H2O(g),5小时后测得反应体系达到平衡状态,此时c(CH4)=0.333mol•L-1,则T=1100℃,该温度下达到平衡时H2的平均生成速率为0.400mol/(L•h)(保留3位有效数字).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
用CxHy(烃)催化还原NOx可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式:CH4+2NO2 $\stackrel{催化剂}{→}$N2+CO2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.
固体电解质里O2-的移动方向是向负极(填“正极”或“负极”)移动,该电池负极的电极反应式为C2H6O+6O2--12e-=2CO2+3H2O.
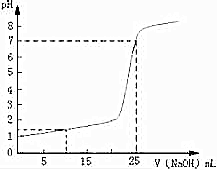 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示: