题目内容
13.足量块状铁与100mL 0.01mol/L的稀硫酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )①加H2O
②加NaOH固体
③加CH3COONa固体
④加Na2CO3固体
⑤加入NaNO3固体
⑥加NaCl溶液
⑦滴入几滴硫酸铜溶液
⑧升高温度
⑨将块状铁改为铁粉
⑩将稀硫酸改用98%的浓硫酸.
| A. | ⑧⑨⑩ | B. | ⑦⑧⑨ | C. | ③⑦⑩ | D. | ⑦⑧⑩ |
分析 为加快铁与盐酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答.
解答 解:①加H2O,浓度降低,反应速率减小,故错误;
②加NaOH固体,盐酸浓度降低,反应速率减小,故错误;
③加CH3COONa固体,生成弱酸,氢离子浓度降低,反应速率减小,故错误;
④加Na2CO3固体,消耗盐酸,改变H2的产量,故错误;
⑤加入NaNO3固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,故错误;
⑥加NaCl溶液,溶液浓度降低,反应速率减小,故错误;
⑦滴加几滴硫酸铜溶液,生成铜,形成原电池反应,加快反应速率,故正确;
⑧升高温度(不考虑盐酸挥发),反应速率增大,故正确;
⑨将块状铁改为铁粉,固体表面积增大,反应速率增大,故正确;
⑩将稀硫酸改用98%的浓硫酸,与铁反应不发生氢气,故错误.
故选B.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,本题不改变生成氢气总量的要求,答题时注意审题,难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
1.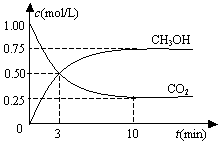 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
| A. | 反应进行到3 min时,该反应达到平衡状态 | |
| B. | 从反应开始到平衡,CO2的转化率为25% | |
| C. | 第3 min时,氢气的平均反应速率为1.5mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
18.下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
5.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法不正确的是( )
| A. | KClO3发生还原反应 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | 每生成1 mol ClO2,转移的电子数约为6.02×1023 |
11.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
①反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=1.975;2.00min~5.00min内,O2的平均反应速率为0.055mol•L-1•min-1.
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
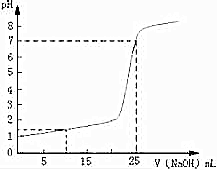 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示: