题目内容
20.二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
(1)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-245.6kJ/mol,化学平衡常数的表达式K=K=K12.K2.K3
(2)普通工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动.
(3)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,
其CO的平衡转化率随温度、压强变化关系如图所示:
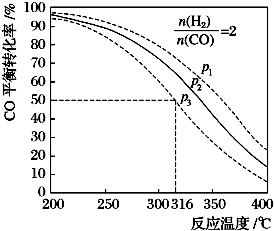
则该反应的△H<0(填“>”或“<”或“=”),在P3和316℃反应达到平衡时,H2的转化率等于50%,图中压强的大小关系为P1>P2>P3,理由是增大压强平衡正向移动CO转化率增大.
(4)以二甲醚(CH3OCH3)为原料设计电池,一个电极通入空气,另一个电极通入二甲醚蒸气,KOH溶液为电解质,则该电池的负极反应式为CH3OCH3-12e-+16OH -=2CO32-+11H2O .
分析 (1)由盖斯定律可知,通过①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),△H进行相应的改变;化学平衡常数K=K12.K2.K3;
(2)新工艺中反应③消耗反应②中的产物H2O,减小生成物的浓度,有利于平衡向正反应方向移动;
(3)升高温度CO转化率降低,说明平衡逆向移动;H2和CO的物质的量之比等于系数比,则两者的转化率相等;相同温度下,增大压强平衡正向移动,则CO转化率增大;
(4)该燃料电池中,负极上二甲醚失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子.
解答 解:(1)2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ.mol-1 ①
2CH3OH(g)?CH3OCH(g)+H2O (g)△H=-24.5kJ.mol-1②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1kJ.mol-1③
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=-90.0kJ/mol×2-24.5kJ/mol-41.1kJ/mol=-245.6kJ/mol,所以热反应方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-245.6kJ/mol,化学平衡常数K=K12.K2.K3;
故答案为:-245.6kJ/mol;K12.K2.K3;
(2)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率,
故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动;
(3)升高温度CO转化率降低,说明平衡逆向移动,则正反应是放热反应,△H<0;H2和CO的物质的量之比等于系数比,则两者的转化率相等,则氢气转化率为50%;相同温度下,增大压强平衡正向移动,则CO转化率增大,根据CO转化率知,P1>P2>P3,
故答案为:<;50%;P1>P2>P3;增大压强平衡正向移动CO转化率增大;
(4)二甲醚、空气、KOH溶液为原料总电池反应方程式为:CH3OCH3+3O2+4OH-=2CO32-+5H2O,正极电极反应式为:3O2+6H2O+2e-=12e-,负极反应式为CH3OCH3-12e-+16OH -=2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH -=2CO32-+11H2O.
点评 本题考查化学平衡计算、外界条件对化学平衡移动影响、原电池原理等知识点,侧重考查学生对化学平衡移动影响因素的理解和灵活运用,知道温度、压强如何影响平衡移动,难点是(4)题电极反应式的书写.

(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H1=-a kJ•mol-1.
已知:H2O(l)═H2O(g)△H2=+b kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-c kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-(a+3b-2c)kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O(g)?CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
②T℃时,向2L密闭容器中投入2.00molCH4和2.00mol H2O(g),5小时后测得反应体系达到平衡状态,此时c(CH4)=0.333mol•L-1,则T=1100℃,该温度下达到平衡时H2的平均生成速率为0.400mol/(L•h)(保留3位有效数字).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
用CxHy(烃)催化还原NOx可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式:CH4+2NO2 $\stackrel{催化剂}{→}$N2+CO2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.
固体电解质里O2-的移动方向是向负极(填“正极”或“负极”)移动,该电池负极的电极反应式为C2H6O+6O2--12e-=2CO2+3H2O.
| A. | F-的原子结构示意图: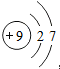 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |
 丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.
丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇(CH3OH)蒸汽和水蒸气CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示恒压容器中充入1mol CO2和3mol H2,转化率达50%时放出热量19.6KJ写出该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-39.2 kJ•mol-1.
(2)另外工业上还可用CO和H2制备甲醇. 反应为CO(g)+2H2(g)═CH3OH(g),某温度下,在容积为2L的恒容密闭容器中进行该反应,其相关数据如图:t min至2t min时速率变化的原因可能是升温或使用了催化剂;
(3)CO2在一定条件下,还可以与H2合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g).
将2.5mol H2与b mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得实验数据如表:
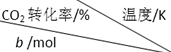 | 500 | 600 | 700 | 800 |
| 1.67 | X | 33 | ||
| 1.25 | 60 | 43 | Y | |
| 0.83 | Z | 32w |
②表中y、z的大小关系为B.
A.y=z B.y>z C.y<z D.无法判断
③表中x、y、z、w对应的平衡常数分别为Kx、Ky、Kz、Kw,它们之间的大小关系为Kx>Kz>Ky=Kw.
| A. | 5 L Cl2与5 L HCl | |
| B. | 36 g H2O与44.8 L CO2 | |
| C. | 25℃,1.01×105 Pa时,等体积的空气与H2 | |
| D. | 0.2 mol O2与标准状况下2.24 L水 |
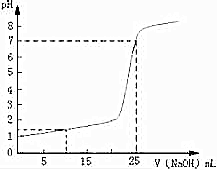 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示: