题目内容
3.对于可逆反应mA+nB?pC正反应的反应热为△H.分别改变温度、压强、B的物质的量导致平衡常数(K)、A的转化率(a%)、A的物质的量浓度[c(A)]发生如图所示的变化.根据图中变化情况,以下结论正确的是( )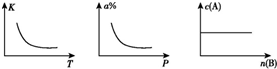
| A. | m+n<p,△H>0 A、B、C均为气体 | B. | m<p△H<0 A、C均为气体 | ||
| C. | n>p,△H>0 B、C均为气体 | D. | m>p,△H<0 A、C均为气体 |
分析 由图可看出,温度升高,K减小,因而平衡左移,逆反应为吸热;压强增加,a%减小,平衡左移;增加B的量,c(A)不变,说明平衡不移动,根据平衡移动原理来回答判断.
解答 解:由图可看出,温度升高,K减小,因而平衡左移,逆反应为吸热,正反应为放热,△H<O;压强增加,a%减小,平衡左移,所以m<p;增加B的量,c(A)不变,说明平衡不移动,故B不是气体.
故选B.
点评 本题以图象的方式考查学生平衡移动原理的应用知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
14.下列说法正确的是( )


| A. | 用甲图装置电解精炼镁 | |
| B. | 用乙图装置验证试管中铁丝发生析氢腐蚀 | |
| C. | 用丙图装置构成铜锌原电池 | |
| D. | 用丁图装置对充电电池进行充电 |
11.CaCO3溶于盐酸生成CO2:CaCO3+2HCl═CaCl2+CO2↑+H2O.则下列说法中,正确的是( )
| A. | 该反应的离子方程式为CO32-+2H+═CO2↑+H2O | |
| B. | 与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大 | |
| C. | CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使其ksp增大 | |
| D. | CaCO3与适量的盐酸恰好完全反应所得溶液中c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
18.现有带活塞的密闭容器A和B,一定温度时容器A装入碘化氢气体、容器B装入二氧化氮气体,使其体积相等.当温度不变时,缓缓压缩两容器,使两容器的压强均为原来的4倍,此时两容器内气体的体积关系正确的是(所有物质始终为气态)( )
| A. | A=B | B. | A<B | C. | 无法判断 | D. | A>B |
8.物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 两溶液加入等质量的锌粉,产生氢气的速率相同 | |
| B. | 两溶液中氢氧根离子浓度均为10-13 mol/L | |
| C. | 加入醋酸钠固体,二者的pH均增大 | |
| D. | 恰好完全反应时,二者消耗氢氧化钠的质量相同 |
15.短周期元素A、B、C、D中,A既可以形成阳离子又能形成简单阴离子,且非金属性A<D,B、C、D三种元素在同一周期且最外层电子数之和为11,B、D最外层电子数之和是B、C最外层电子数之和的2倍,B的最高价氧化物的水化物在短周期中碱性最强,下列判断不正确的是( )
| A. | 离子半径:D>B>C>A | |
| B. | 金属性:B>C | |
| C. | A、D最高化合价与最低化合价的代数和分别为0和6 | |
| D. | B和A、C形成的氧化物均不反应 |
6.下列关于有机物的说法正确的是( )
| A. | 乙烷的沸点低于甲烷,密度大于甲烷 | |
| B. | 相对分子质量相近的醇和烷烃,醇的沸点远高于烷烃 | |
| C. | 苯酚在任何温度下,均微溶于水 | |
| D. | 酯在碱性条件下的水解反应均为皂化反应 |
7.产物主要是Fe2O3的反应是( )
| A. | 铁在纯氧中燃烧 | B. | 红热的铁和水蒸气反应 | ||
| C. | Fe2(CO4)3与氨水混合 | D. | 灼烧氢氧化铁固体 |
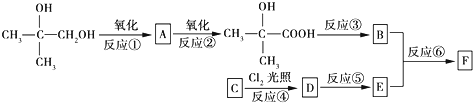
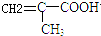 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$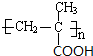 .
.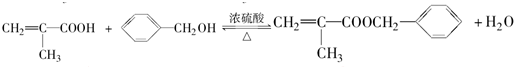 .
.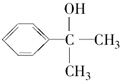 .
.