题目内容
14.下列说法正确的是( )
| A. | 用甲图装置电解精炼镁 | |
| B. | 用乙图装置验证试管中铁丝发生析氢腐蚀 | |
| C. | 用丙图装置构成铜锌原电池 | |
| D. | 用丁图装置对充电电池进行充电 |
分析 A、该装置中阴极上氢离子放电;
B、酸性条件下,铁发生析氢腐蚀;
C、该装置不符合原电池构成条件;
D、二次电池充电时,其阳极与原电池正极相连.
解答 解:A、该装置中阴极上氢离子放电,所以阴极上得不到金属Mg单质,故A错误;
B、酸性条件下,铁发生析氢腐蚀,氯化铵为强酸弱碱盐,其溶液呈酸性,所以该溶液中铁发生析氢腐蚀,故B正确;
C、该装置不符合原电池构成条件,中间应该使用盐桥,不是金属铜,故C错误;
D、二次电池充电时,阳极上失电子发生氧化反应,所以其阳极与原电池正极相连,故D错误;
故选B.
点评 本题考查了原电池和电解池原理,涉及原电池的构成条件、金属的腐蚀与防护、电解精炼等知识点,知道各个电极上发生的电极反应,易错选项是D,注意:二次电池充电时电极如何连接原电池电极,为易错点.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
4.下列化学方程式与结论均正确的是( )
| 选项 | 方程式 | 结论 |
| A | 2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq) | 溶解度:Ag2S>AgI |
| B | C(s.石墨)═C(s.金刚石)△H>0 | 稳定性:金刚石>石墨 |
| C | 3Fe2++NO${\;}_{3}^{-}$+10H+═3Fe3++3H2O+NH${\;}_{4}^{+}$ | 还原性:Fe2+>NH${\;}_{4}^{+}$ |
| D | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| A. | A | B. | B | C. | C | D. | D |
6.用下列实验装置进行相应实验,设计正确且能达到实验目的是( )
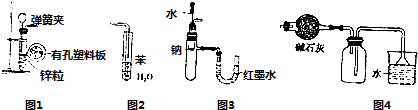

| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置吸收氨气以防止倒吸 | |
| C. | 用图3所示装置验证Na和水反应的热效应 | |
| D. | 用图4所示装置可用于干燥、收集氯化氢气体 |
3.对于可逆反应mA+nB?pC正反应的反应热为△H.分别改变温度、压强、B的物质的量导致平衡常数(K)、A的转化率(a%)、A的物质的量浓度[c(A)]发生如图所示的变化.根据图中变化情况,以下结论正确的是( )
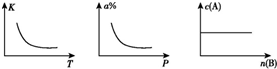

| A. | m+n<p,△H>0 A、B、C均为气体 | B. | m<p△H<0 A、C均为气体 | ||
| C. | n>p,△H>0 B、C均为气体 | D. | m>p,△H<0 A、C均为气体 |
18.设NA表示阿伏伽德罗常数的值,下列说法正确的是(相对原子质量:H-1,N-14)( )
| A. | 标准状况下,22.4LHCl溶于水后溶液中含有NA个HCl分子 | |
| B. | 常温常压下,33.6LCl2中含有1.5NA个Cl2分子 | |
| C. | 1.8g的NH4+离子中含有NA个电子 | |
| D. | 将0.1mol氯化铝溶于1L水中,所得溶液含有0.1NAAl3+ |

 (1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:
(1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题: