题目内容
11.CaCO3溶于盐酸生成CO2:CaCO3+2HCl═CaCl2+CO2↑+H2O.则下列说法中,正确的是( )| A. | 该反应的离子方程式为CO32-+2H+═CO2↑+H2O | |
| B. | 与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大 | |
| C. | CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使其ksp增大 | |
| D. | CaCO3与适量的盐酸恰好完全反应所得溶液中c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
分析 A.根据CaCO3是难溶性盐,应保留化学式;
B.根据固体的表面积越大,化学反应速率越大;
C.根据H+ 能与CO32-反应以及Ksp只与温度有关;
D.CaCO3与适量的盐酸恰好完全反应是氯化钙、碳酸的水溶液以及质子守恒来分析.
解答 解:A.该反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故A错误;
B.与同浓度的盐酸反应,块状大理石的反应速率比粉末状的小,故B错误;
C.H+ 能与CO32-反应促进了CaCO3的沉淀溶解平衡正向移动,温度不变,所以Ksp也不变,故C错误;
D.CaCO3与适量的盐酸恰好完全反应是氯化钙、碳酸的水溶液,溶液中的质子守恒为:c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),故D正确;
故选D.
点评 本题主要考查了离子方程式的书写、化学反应速率的影响因素、沉淀溶解平衡以及溶液中的质子守恒,难度不大,注意知识的积累.

练习册系列答案
相关题目
1.下列离子方程式的书写正确的是( )
| A. | 铁和氯化铁溶液反应:Fe3++Fe═2Fe2+ | |
| B. | 醋酸和氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| C. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+H2O | |
| D. | 氢氧化铁和盐酸反应:H++OH-═H2O |
6.用下列实验装置进行相应实验,设计正确且能达到实验目的是( )
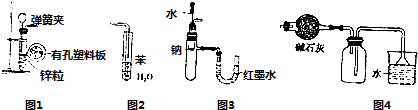

| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置吸收氨气以防止倒吸 | |
| C. | 用图3所示装置验证Na和水反应的热效应 | |
| D. | 用图4所示装置可用于干燥、收集氯化氢气体 |
16.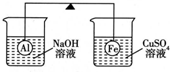 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )| A. | 铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡 | |
| B. | 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉 | |
| C. | 反应后去掉两烧杯,杠杆仍平衡 | |
| D. | 右边球上出现红色,左边溶液的碱性增强 |
3.对于可逆反应mA+nB?pC正反应的反应热为△H.分别改变温度、压强、B的物质的量导致平衡常数(K)、A的转化率(a%)、A的物质的量浓度[c(A)]发生如图所示的变化.根据图中变化情况,以下结论正确的是( )
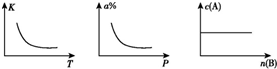

| A. | m+n<p,△H>0 A、B、C均为气体 | B. | m<p△H<0 A、C均为气体 | ||
| C. | n>p,△H>0 B、C均为气体 | D. | m>p,△H<0 A、C均为气体 |
20.下列物质的分子热稳定性最好的是( )
| A. | CH4 | B. | NH3 | C. | H2O | D. | HF |
15.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$发烟硝酸 | |
| B. | Al2O3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$→_{熔融}^{电解}$Al | |
| C. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{蔗糖}$Cu2O | |
| D. | SiO2$→_{高温}^{Na_{2}CO_{3}}$Na2SiO3$\stackrel{盐酸}{→}$硅酸凝胶 |
