题目内容
8.物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )| A. | 两溶液加入等质量的锌粉,产生氢气的速率相同 | |
| B. | 两溶液中氢氧根离子浓度均为10-13 mol/L | |
| C. | 加入醋酸钠固体,二者的pH均增大 | |
| D. | 恰好完全反应时,二者消耗氢氧化钠的质量相同 |
分析 盐酸是强酸,完全电离,醋酸是弱酸,部分电离,所以溶液中c(H+)盐酸>醋酸,据此分析.
解答 解:A、盐酸是强酸,完全电离,醋酸是弱酸,部分电离,所以溶液中c(H+):盐酸>醋酸,所以与Zn反应生成氢气的速率:盐酸>醋酸,故A错误;
B、盐酸是强酸,完全电离,氢离子浓度为0.1mol/L,所以氢氧根离子浓度均为10-13 mol/L,醋酸是弱酸,部分电离,所以溶液中c(H+)<0.1mol/L,所以溶液中氢氧根离子浓度均大于10-13 mol/L,故B错误;
C、向盐酸中加入醋酸钠晶体,醋酸钠和盐酸反应生成醋酸,导致溶液的pH增大,向醋酸中加入醋酸钠,能抑制醋酸电离,导致其溶液的pH增大,故C正确;
D、酸的浓度相同,但是体积大小不知,无法比较消耗氢氧化钠的多少,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡应用,弱酸在溶液中部分电离,其氢离子浓度一定小于酸的浓度,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
18. 电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )
 电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )| A. | 石墨电极上发生氧化反应 | |
| B. | 根据图示,物质A为CO2 | |
| C. | 为增强污水的导电能力,可向污水中加入适量乙醇 | |
| D. | 甲烷燃料电池中CO32-向空气一极移动 |
16.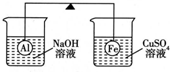 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )| A. | 铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡 | |
| B. | 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉 | |
| C. | 反应后去掉两烧杯,杠杆仍平衡 | |
| D. | 右边球上出现红色,左边溶液的碱性增强 |
3.对于可逆反应mA+nB?pC正反应的反应热为△H.分别改变温度、压强、B的物质的量导致平衡常数(K)、A的转化率(a%)、A的物质的量浓度[c(A)]发生如图所示的变化.根据图中变化情况,以下结论正确的是( )
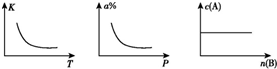

| A. | m+n<p,△H>0 A、B、C均为气体 | B. | m<p△H<0 A、C均为气体 | ||
| C. | n>p,△H>0 B、C均为气体 | D. | m>p,△H<0 A、C均为气体 |
20.下列物质的分子热稳定性最好的是( )
| A. | CH4 | B. | NH3 | C. | H2O | D. | HF |
11.(一)某课外实验活动小组拟用下列装置和药品制备无水氯化铁晶体,该物质极易潮解,100℃左右时升华,完成下列问题:
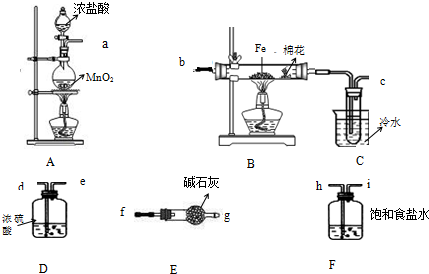
(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.

(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.
| 提出假设 | 加入试剂及操作 | 实验现象 | 得出结论 |
| 假设1:含Fe2+(甲) | 取少许溶液少许,先滴入KSCN溶液,然后再滴入几滴氯水(乙) | 溶液先无明显变化,后变为血红色 | 含该离子 |
| 假设2:含Fe3+ | 滴入几滴KSCN溶液 | 溶液变为血红色 | 含Fe3+ |
| 假设3:含Fe2+、Fe3+ | 取A、B两等份溶液少许,A加入少量高锰酸钾溶液(丙); B加入KSCN溶液 | A溶液紫色退为无色(丁),B溶液变为血红色 | 二者都存在 |
12. 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | Kl溶液 | D. | 饱和食盐水 |