题目内容
7.产物主要是Fe2O3的反应是( )| A. | 铁在纯氧中燃烧 | B. | 红热的铁和水蒸气反应 | ||
| C. | Fe2(CO4)3与氨水混合 | D. | 灼烧氢氧化铁固体 |
分析 A、铁在纯氧中燃烧生成四氧化三铁;
B、红热的铁和水蒸气反应,生成四氧化三铁和氢气;
C、Fe2(CO4)3与氨水混合生成氢氧化铁;
D、灼烧氢氧化铁固体生成氧化铁和水.
解答 解:A、铁在纯氧中燃烧生成四氧化三铁,而不是氧化铁,故A错误;
B、红热的铁和水蒸气反应,生成四氧化三铁和氢气,而不是氧化铁,故B错误;
C、Fe2(CO4)3与氨水混合生成氢氧化铁,而不是氧化铁,故C错误;
D、灼烧氢氧化铁固体生成氧化铁和水,故D正确;
故选D.
点评 本题考查了铁及其氧化物的性质,题目难度不大,注意掌握铁及其化合物的性质,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.对于可逆反应mA+nB?pC正反应的反应热为△H.分别改变温度、压强、B的物质的量导致平衡常数(K)、A的转化率(a%)、A的物质的量浓度[c(A)]发生如图所示的变化.根据图中变化情况,以下结论正确的是( )
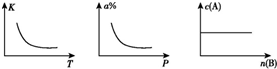

| A. | m+n<p,△H>0 A、B、C均为气体 | B. | m<p△H<0 A、C均为气体 | ||
| C. | n>p,△H>0 B、C均为气体 | D. | m>p,△H<0 A、C均为气体 |
18.设NA表示阿伏伽德罗常数的值,下列说法正确的是(相对原子质量:H-1,N-14)( )
| A. | 标准状况下,22.4LHCl溶于水后溶液中含有NA个HCl分子 | |
| B. | 常温常压下,33.6LCl2中含有1.5NA个Cl2分子 | |
| C. | 1.8g的NH4+离子中含有NA个电子 | |
| D. | 将0.1mol氯化铝溶于1L水中,所得溶液含有0.1NAAl3+ |
15.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$发烟硝酸 | |
| B. | Al2O3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$→_{熔融}^{电解}$Al | |
| C. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{蔗糖}$Cu2O | |
| D. | SiO2$→_{高温}^{Na_{2}CO_{3}}$Na2SiO3$\stackrel{盐酸}{→}$硅酸凝胶 |
12. 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | Kl溶液 | D. | 饱和食盐水 |
19.下列除去杂质的方法,正确的是( )
| A. | 除去乙烷中少量的乙烯:催化剂条件下通入H2 | |
| B. | 乙醇中含有乙酸杂质:加入 碳酸钠溶液,分液 | |
| C. | FeCl3溶液中含有CuCl2杂质:加入过量铁粉,过滤 | |
| D. | CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
16.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论错误的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中加入Na2CO3粉末,有气泡产生,说明氯水中含有H+ | |
| C. | 向KI溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
17.制取漂白粉的化学方程式是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,该反应的氧化剂与还原剂之比为( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 3:2 |