题目内容
6.下列关于有机物的说法正确的是( )| A. | 乙烷的沸点低于甲烷,密度大于甲烷 | |
| B. | 相对分子质量相近的醇和烷烃,醇的沸点远高于烷烃 | |
| C. | 苯酚在任何温度下,均微溶于水 | |
| D. | 酯在碱性条件下的水解反应均为皂化反应 |
分析 A.烷烃的相对分子质量越大,沸点越高,密度越大;
B.醇含有羟基,可形成氢键;
C.苯酚易溶于热水中;
D.油脂在碱性条件下的水解为皂化反应.
解答 解:A.烷烃的相对分子质量越大,分子间作用力越强,对应的沸点越高,密度越大,故A错误;
B.醇含有羟基,可形成氢键,氢键作用力比范德华力强,醇的沸点较高,故B正确;
C.苯酚微溶于冷水,但易溶于热水中,故C错误;
D.油脂在碱性条件下的水解为皂化反应,故D错误.
故选B.
点评 本题考查有机物结构和性质、基本概念等知识点,为高频考点,有利于培养学生良好的科学素养,明确物质结构与性质关系、基本概念之间区别是解本题关键,题目难度不大.

练习册系列答案
相关题目
3.对于可逆反应mA+nB?pC正反应的反应热为△H.分别改变温度、压强、B的物质的量导致平衡常数(K)、A的转化率(a%)、A的物质的量浓度[c(A)]发生如图所示的变化.根据图中变化情况,以下结论正确的是( )


| A. | m+n<p,△H>0 A、B、C均为气体 | B. | m<p△H<0 A、C均为气体 | ||
| C. | n>p,△H>0 B、C均为气体 | D. | m>p,△H<0 A、C均为气体 |
20.下列物质的分子热稳定性最好的是( )
| A. | CH4 | B. | NH3 | C. | H2O | D. | HF |
1. Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当改变条件,再次达到平衡时,下列有关叙述不正确的是( )
 Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E | |
| B. | 若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同 | |
| D. | 若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同 |
11.(一)某课外实验活动小组拟用下列装置和药品制备无水氯化铁晶体,该物质极易潮解,100℃左右时升华,完成下列问题:
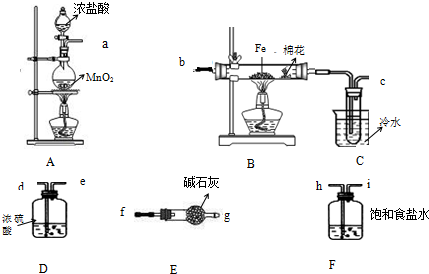
(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.

(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.
| 提出假设 | 加入试剂及操作 | 实验现象 | 得出结论 |
| 假设1:含Fe2+(甲) | 取少许溶液少许,先滴入KSCN溶液,然后再滴入几滴氯水(乙) | 溶液先无明显变化,后变为血红色 | 含该离子 |
| 假设2:含Fe3+ | 滴入几滴KSCN溶液 | 溶液变为血红色 | 含Fe3+ |
| 假设3:含Fe2+、Fe3+ | 取A、B两等份溶液少许,A加入少量高锰酸钾溶液(丙); B加入KSCN溶液 | A溶液紫色退为无色(丁),B溶液变为血红色 | 二者都存在 |
18.设NA表示阿伏伽德罗常数的值,下列说法正确的是(相对原子质量:H-1,N-14)( )
| A. | 标准状况下,22.4LHCl溶于水后溶液中含有NA个HCl分子 | |
| B. | 常温常压下,33.6LCl2中含有1.5NA个Cl2分子 | |
| C. | 1.8g的NH4+离子中含有NA个电子 | |
| D. | 将0.1mol氯化铝溶于1L水中,所得溶液含有0.1NAAl3+ |
15.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$发烟硝酸 | |
| B. | Al2O3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$→_{熔融}^{电解}$Al | |
| C. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{蔗糖}$Cu2O | |
| D. | SiO2$→_{高温}^{Na_{2}CO_{3}}$Na2SiO3$\stackrel{盐酸}{→}$硅酸凝胶 |
16.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论错误的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中加入Na2CO3粉末,有气泡产生,说明氯水中含有H+ | |
| C. | 向KI溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
