题目内容
4. 一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:
一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:①CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=210.5kJ•mol-1
②$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H2=-47.3kJ•mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-399.7kJ•mol-1;平衡时增大压强,此反应正向(“正向”、“逆向”、“不”)移动.
(2)已知298K时,Ksp(CaCO3)=m×10-p,Ksp(CaSO4)=n×10-q.则反应:CaCO3+SO42-?CaSO4+CO32-的平衡常数数值表示式为$\frac{m}{n}×1{0}^{q-p}$(用含m、n、p、q的式子表示).
(3)用碘量法可测定排放烟气中二氧化硫的含量,请写出碘溶液与二氧化硫发生氧化还原反应的离子方程式I2+SO2+2H2O=SO42-+2I-+4H+;
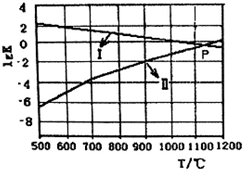
(4)反应①②的平衡常数的对数lgK随反应T的变化曲线见图,其中曲线Ⅰ代表②反应,P为两曲线交点,则在该温度下两反应均达平衡时,体系中c(SO2)=1mol•L-1,从减少二氧化硫排放的角度来考虑,本体系适宜的反应条件是B.
A.低温低压 B.低温高压 C.高温高压 D.高温低压.
分析 (1)利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)反应热;
(2)CaCO3+SO42-?CaSO4+CO32-的平衡常数=$\frac{c(C{{O}_{3}}^{2-})}{c(S{{O}_{4}}^{2-})}$=$\frac{{K}_{sp}(CaC{O}_{3})}{{K}_{sp}(CaS{O}_{4})}$;
(3)碘溶液与二氧化硫发生氧化还原反应生成SO42-、I-;
(4)lgK越大,说明K越大,结合温度对平衡移动的影响判断平衡移动的方向;P为两曲线交点,说明①②的平衡常数相等;结合外界条件对平衡移动的影响解答该题.
解答 解:(1)利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=4×(-47.3kJ•mol-1)-(210.5kJ•mol-1)=-399.7kJ•mol-1,由方程式可知增大压强,平衡向正向移动,
故答案为:-399.7;正向;
(2)CaCO3+SO42-?CaSO4+CO32-的平衡常数=$\frac{c(C{{O}_{3}}^{2-})}{c(S{{O}_{4}}^{2-})}$=$\frac{{K}_{sp}(CaC{O}_{3})}{{K}_{sp}(CaS{O}_{4})}$=$\frac{m}{n}×1{0}^{q-p}$,故答案为:$\frac{m}{n}×1{0}^{q-p}$;
(3)碘具有氧化性,二氧化硫具有还原性,碘溶液与二氧化硫发生氧化还原反应生成SO42-、I-,反应的离子方程式为I2+SO2+2H2O=SO42-+2I-+4H+,
故答案为:I2+SO2+2H2O=SO42-+2I-+4H+;
(4)lgK越大,说明K越大,随着温度的升高,反应②向逆向移动,则lgK减小,说明曲线Ⅰ代表②的反应;
P为两曲线交点,说明①②的平衡常数相等,则$\frac{c(C{O}_{2})c(S{O}_{2})}{c(CO)}$=$\frac{c(C{O}_{2})}{c(CO)}$,则体系中c(SO2)=1mol•L-1,
反应①生成二氧化硫,如减少二氧化硫的排放,应使平衡逆向移动,则条件为低温高压,
故答案为:②;1; B.
点评 本题考查化学平衡移动问题,涉及化学平衡以及反应热与焓变的考查,侧重于学生的分析能力和计算能力的考查,题目较为综合,涉及面广,题目难度中等.

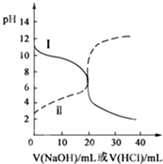 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间时:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| A. | 若浓硫酸不慎洒落在皮肤上应立即用干布拭去,再用大量水冲洗 | |
| B. | 可使蔗糖变黑,体现了浓硫酸的吸水性 | |
| C. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | |
| D. | 可使胆矾变白,体现了浓硫酸的脱水性 |
| 步骤 | 操作 | 现象 |
| (1) | 取少量溶液滴加几滴石蕊试液 | 溶液变蓝 |
| (2) | 另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 | 上层无色,下层呈紫色 |
| (3) | 取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有 Cl-、SO32-、SO42- | B. | 肯定没有 Ba2 +、Cl-、I- | ||
| C. | 不能确定 Na+、SO32-、SO42- | D. | 肯定含有 Na+、I-、SO32- |
| A. | 原子半径X>Y>Z | B. | 气态氢化物稳定性 HX<HY<HZ | ||
| C. | 非金属性X>Y>Z | D. | 阴离子的还原性X->Y->Z- |
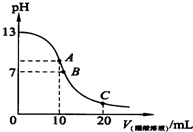 已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.
已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.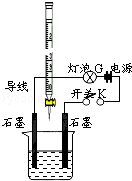 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.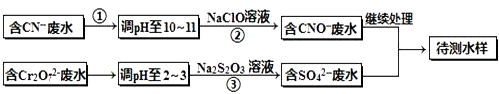
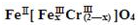 (铁氧磁体,罗马数字表示元素价态)的沉淀.
(铁氧磁体,罗马数字表示元素价态)的沉淀.