题目内容
12.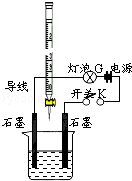 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.(1)实验时,滴定管中应盛A(选A或B)溶液.
(2)若A为一元强酸,B为一元强碱,且a+b=14.该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、…20).断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为5,原因是反应后烧杯中自由离子的浓度约为原溶液的一半.烧杯中得到的溶液pH=7.
(3)若A为强酸,B为强碱,且a+b=14.断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液.此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是A为多元强酸.
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程为R-+H2O?OH-+HR.此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是③⑤(填序号).
①c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-) ②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-) ④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+c(H+)=c(R-)+c(OH-) ⑥c(MOH)=c(H+)-c(OH-)
分析 (1)根据根据图示中滴定管构造可知,该滴定管为酸式滴定管,则滴定管中盛放的为酸,即A溶液;
(2)根据该温度下的水的离子积判断两溶液反应后溶液酸碱性及溶液中离子浓度大小,从而判断溶液导电性大小;根据水的离子积计算出中性溶液中氢离子浓度,再计算出溶液的pH;
(3)根据电荷守恒判断溶液中阳离子浓度大于阴离子浓度原因;
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性.说明酸是弱酸;从盐类的水解以及电荷守恒角度分析,注意两者等体积混合后溶液显酸性的信息.
解答 解:(1)根据图示中滴定管构造可知,该滴定管为酸式滴定管,则滴定管中盛放的为酸,即A溶液,
故答案为:A;
(2)该温度下,水的离子积Kw=l×10-14,a+b=14的一元强酸和一元强碱等体积混合,溶液呈中性,反应后的溶液为盐溶液,由于体积变成原先的2倍,离子浓度则变为原先的$\frac{1}{2}$,所以溶液的导电性为5;根据水的离子积可知,该温度下,中性溶液中氢离子浓度为:l×10-7mol/L,溶液的pH=7,
故答案为:5;反应后烧杯中自由离子的浓度约为原溶液的一半;7;
(3)当溶液呈中性时,有电荷守恒可知,溶液中阳离子所带电荷总浓度应该等于阴离子所带负电荷总浓度,而现在阳离子浓度大于阴离子浓度,可知1个阴离子所带电荷大于1个阳离子所带电荷,即A为多元强酸,
故答案为:A为多元强酸;
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性.说明酸是弱酸存在电离平衡,则混合溶液中必定是R-离子能发生水解,反应的离子方程式为:R-+H2O?OH-+HR,易判断⑤是正确的电荷守恒关系式,由于溶液呈酸性,故c(OH-)<c(H+),排除②、④,
根据c(OH-)<c(H+)和c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)<c(R-),
由于OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(R-)>c(M+)>c(H+)>c(OH-),即③正确.
c(H+)>c(OH-),由c(MOH)=c(H+)-c(OH-)可得“c(MOH)>0”这与混合溶液中HR有大量剩余,即c(HR)>0不符,故⑥是错误的,
故答案为:R-+H2O?OH-+HR;③⑤.
点评 本题考查了影响溶液导电性因素、强弱电解质的判断,题目难度中等,注意掌握影响溶液导电性因素,易错点为(4),注意溶液离子浓度大小比较的方法,尤其注意解答该题须知:①25℃时,pH之和为14的酸、碱溶液等体积混合,谁弱显谁性,无弱显中性(原因是:二者反应后,弱者有大量剩余,所以弱者电离显性).

| A. | 若a≤b,则混合溶液的pH大于7 | |
| B. | 若a=2b,溶液呈酸性,则[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-] | |
| C. | 混合溶液中[Na+]+[H+]=[OH-]+[CH3COO-]一定成立 | |
| D. | 混合溶液中[CH3COO-]+[CH3COOH]=a mol/L 一定成立 |
| 实验 编号 | HA物质的量 浓度(mol•L-1) | NaOH物质的量 浓度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X(g)+3Y(g)?2Z(g),其平衡常数为1600 (L/mol)2 | |
| C. | 增大压强,平衡常数增大 | |
| D. | 改变温度可以改变此反应的平衡常数 |
| A. | Ne | B. | N | C. | Na | D. | K |
 一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:
一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下: ,离子键,共价键;
,离子键,共价键;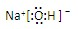 ,离子键,共价键;
,离子键,共价键; ;共价键;
;共价键; ,共价键,离子键.
,共价键,离子键.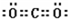 ;共价键;
;共价键; ;共价键.
;共价键.