题目内容
15. 已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.
已知25℃时,0.10mol.L-1的CH3COOH的电离度为1.3%,pH=3.1.(1)某温度下,测得1L 0.10mol.L-1的CH3COOH溶液中CH3COOH的电离平衡常数K=1.7×10-5.则向该溶液中再加入1.7×10-2mol CH3COONa可使溶液的pH约为4(溶液体积变化和H2O的电离均忽略不计).
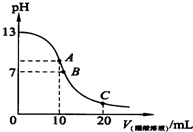
(2)25℃时,在20ml Ba(OH)2溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,试回答以下问题:
①A点各离子浓度大小关系为c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+)
②取20ml这种Ba(OH)2溶液加水稀释到200ml,
所得溶液中由水电离出的氢离子浓度为1×10-12mol•L-1
③若C点PH=3,则C(CH3COOH)+C(H+)=0.05mol.L-1.
分析 (1)根据醋酸的电离平衡常数等于醋酸根离子浓度和氢离子浓度乘与醋酸浓度的比值来计算;
(2)①20mlBa(OH)2溶液的pH=13,所以氢氧化钡的浓度是0.05mol/L,其中逐滴加入0.2mol/L醋酸溶液,恰好反应会生成醋酸钡和水,据此回答计算;
②溶液稀释前后溶质的物质的量不变,但是体积增加,浓度会减小;
③根据反应中的电荷守恒、物料守恒、质子守恒知识来判断.
解答 解:(1)设:向该溶液中再加入xmol CH3COONa可使溶液的pH约为4,根据CH3COOH的电离平衡常数K=1.7×10-5=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-4}x}{0.1}$,解得x=1.7×10-2,故答案为:1.7×10-2;
(2)①20mlBa(OH)2溶液的pH=13,所以氢氧化钡的浓度是0.05mol/L,其中逐滴加入0.2mol/L醋酸溶液10mL,此时A点是二者恰好反应生成醋酸钡和水,溶液中离子浓度关系是:c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+),故答案为:c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+);
②取20ml浓度是0.05mol/LBa(OH)2溶液加水稀释到200ml,所得溶液中氢氧根离子浓度c=$\frac{0.02L×0.05mol/L×2}{0.2L}$=0.01mol/L,所得溶液中由水电离出的氢离子浓度为$\frac{1{0}^{-14}}{0.01}$mol/L=1×10-12mol•L-1,故答案为:1×10-12mol•L-1;
③在20ml0.05mol/L Ba(OH)2溶液中逐滴加入0.2mol/L醋酸溶液20mL,C点得到的是醋酸钡和醋酸的混合物,此时溶液显示酸性,PH=3,存在电荷守恒:
a、2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),b、c(Ba2+)=0.05mol/L;物料守恒:c、c(CH3COO-)+c(CH3COOH)=3c(Ba2+)=0.15mol/L,溶液显示酸性,pH=3,所以氢氧根离子浓度近似等于10-11mol/L,整理a、b、c得到:c(CH3COOH)+c(H+)=0.05mol•L-1.故答案为:0.05mol•L-1.
点评 本题考查学生电离平衡常数的计算、酸碱中和滴定过程中离子浓度大小关系比较以及三大守恒思想的应用知识,属于综合知识的考查,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 己烷不能使Br2的四氯化碳溶液褪色而己烯能使其褪色 | |
| B. | 葡萄糖与新制的Cu(OH)2悬浊液共热生成砖红色而果糖不能 | |
| C. | 苯酚( )与溴的水溶液反应生成白色沉淀而甲苯不能 )与溴的水溶液反应生成白色沉淀而甲苯不能 | |
| D. | 乙烷与Cl2单质发生取代反应而乙烯与Cl2单质易发生加成反应 |
| 实验 编号 | HA物质的量 浓度(mol•L-1) | NaOH物质的量 浓度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X(g)+3Y(g)?2Z(g),其平衡常数为1600 (L/mol)2 | |
| C. | 增大压强,平衡常数增大 | |
| D. | 改变温度可以改变此反应的平衡常数 |
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | a+1=d-2 |
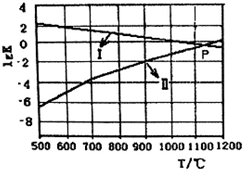 一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:
一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下: