题目内容
13.用电子排布式表示下列原子的电子排布(1)Fe1s22s22p63s23p63d64s2 (2)Cu1s22s22p63s23p63d104s1 (3)Cr1s22s22p63s23p63d54s1 (4)Si1s22s22p63s23p2.
分析 根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写.
解答 解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,故答案为:1s22s22p63s23p63d64s2;
(2)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(3)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(4)Si元素为14号元素,原子核外有14个电子,所以核外电子排布式为:1s22s22p63s23p2,故答案为:1s22s22p63s23p2.
点评 本题考查了基态原子的核外电子排布式,核外电子排布规律来写,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
3.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
| 实验 编号 | HA物质的量 浓度(mol•L-1) | NaOH物质的量 浓度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
1.元素X形成的离子与镁离子的核外电子排布相同,且X的离子半径小于负二价氧离子的半径.X元素可能为( )
| A. | Ne | B. | N | C. | Na | D. | K |
5.已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | a+1=d-2 |
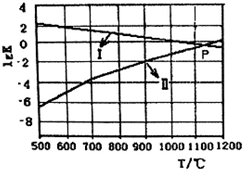 一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:
一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:

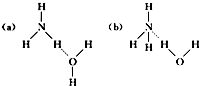
 ,离子键,共价键;
,离子键,共价键;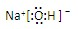 ,离子键,共价键;
,离子键,共价键; ;共价键;
;共价键; ,共价键,离子键.
,共价键,离子键.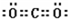 ;共价键;
;共价键; ;共价键.
;共价键.