题目内容
14.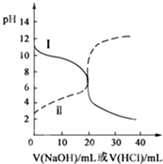 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间时:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
分析 曲线I开始时pH>7,滴定过程中pH减小,是用盐酸滴定氨水,曲线Ⅱ开始时pH<7,滴定过程中pH增大,是用氢氧化钠滴定醋酸.
A.曲线Ⅰ是用盐酸滴定氨水;
B.曲线I中滴加溶液到20mL时,得到NH4Cl溶液,溶液中铵根离子水解,溶液呈酸性;
C.曲线Ⅱ是用氢氧化钠滴定醋酸;
D.曲线Ⅱ中滴加溶液到10mL时,得到等浓度的CH3COOH、CH3COONa混合溶液,结合微粒守恒、电荷守恒判断.
解答 解:曲线I开始时pH>7,滴定过程中pH减小,是用盐酸滴定氨水,曲线Ⅱ开始时pH<7,滴定过程中pH增大,是用氢氧化钠滴定醋酸.
A.曲线Ⅰ是用盐酸滴定氨水,故A错误;
B.曲线I中滴加溶液到20mL时,得到NH4Cl溶液,溶液中铵根离子水解,溶液呈酸性,则溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.曲线Ⅱ是用氢氧化钠滴定醋酸,故C错误;
D.曲线Ⅱ中滴加溶液到10mL时,得到等浓度的CH3COOH、CH3COONa混合溶液,根据物料守恒可得:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),联立可得:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正确.
故选:D.
点评 本题考查中和滴定、离子浓度大小比较,关键是根据滴定曲线判断相互滴定的物质,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解判断溶液中离子浓度大小.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是( )
| A. | 若a≤b,则混合溶液的pH大于7 | |
| B. | 若a=2b,溶液呈酸性,则[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-] | |
| C. | 混合溶液中[Na+]+[H+]=[OH-]+[CH3COO-]一定成立 | |
| D. | 混合溶液中[CH3COO-]+[CH3COOH]=a mol/L 一定成立 |
9.以下说法不正确的是( )
| A. | 0.1 mol•L-1的盐酸与0.1 mol•L-1的氨水混合,若溶液显中性,则V(盐酸)<V(氨水) | |
| B. | 0.1 mol•L-1的醋酸与等浓度等体积NaOH反应后的溶液中,CH3COOH和CH3COO-浓度关系为:c(CH3COOH)+c(CH3COO-)=0.1 mol•L-1 | |
| C. | pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水) | |
| D. | 已知酸性:HCOOH>HCN,等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
19.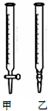 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入
25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为①③⑤⑥
(2)取用25.00 mL待测NaOH溶液应用以下乙(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,
则会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入
25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为①③⑤⑥
(2)取用25.00 mL待测NaOH溶液应用以下乙(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,
则会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.98 |
| 3 | 25.00 | 0.20 | 20.18 |
6.下列有机物的性质差异是由于相同的官能团受不同邻近基团影响而产生的是( )
| A. | 己烷不能使Br2的四氯化碳溶液褪色而己烯能使其褪色 | |
| B. | 葡萄糖与新制的Cu(OH)2悬浊液共热生成砖红色而果糖不能 | |
| C. | 苯酚( )与溴的水溶液反应生成白色沉淀而甲苯不能 )与溴的水溶液反应生成白色沉淀而甲苯不能 | |
| D. | 乙烷与Cl2单质发生取代反应而乙烯与Cl2单质易发生加成反应 |
3.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
| 实验 编号 | HA物质的量 浓度(mol•L-1) | NaOH物质的量 浓度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
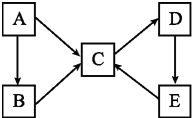 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
 一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:
一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下: