题目内容
5.现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
分析 铝与硫酸反应生成硫酸铝、铝与氢氧化钠反应生成偏铝酸钠,然后根据铝离子与偏铝酸根离子发生双水解得到的氢氧化铝的量最大,则消耗铝的质量也最多,由此分析解答.
解答 解:根据金属铝和酸以及和碱发生反应的化学方程式可以得出:Al~3H+~Al3+~$\frac{3}{2}$H2SO4~Al(OH)3,
Al~OH-~NaOH~[Al(OH)4]-,由可知Al3++3[Al(OH)4]-=4Al(OH)3↓,Al3+~3[Al(OH)4]-~$\frac{3}{2}$H2SO4~3NaOH~4Al(OH)3↓,所以
$\frac{3}{2}$H2SO4~3NaOH~4Al(OH)3↓,
$\frac{3}{2}$ 3 4
0.25L×2.0mol/L=0.5mol 1mol
经比较硫酸和氢氧化钠确好完全反应,所以根据铝原子守恒,则最多时消耗铝的质量为:$\frac{4}{3}$mol×27g/mol=36g,故选B.
点评 本题考查学生由金属铝制得氢氧化铝的实验方案知识,是一道工业生产和化学结合的题目,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为1:1的有( )
| A. | 2-甲基丙烷 | B. | 三硝基甲苯 | C. | 乙酸甲酯 | D. | 乙二酸 |
16.如图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为( )
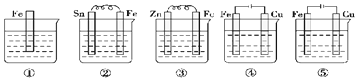

| A. | ⑤②①③④ | B. | ③②⑤④① | C. | ⑤④③②① | D. | ⑤②①④③ |
13.对可逆应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 化学反应速率关系是:2υ正(NH3)=3υ正(H2O) | |
| B. | 达到化学平衡时,4υ正(O2)=5υ逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
10.配制一定物质的量浓度溶液时,会导致所配溶液浓度偏大的操作是( )
| A. | 在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中 | |
| B. | 用量筒量取浓硫酸时,俯视刻度线 | |
| C. | 用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 | |
| D. | 定容时俯视刻度线 |
17.在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是( )
| A. | 水、氢氧化钾溶液、稀盐酸 | B. | 水、氢氧化钠溶液、稀盐酸? | ||
| C. | 水、硝酸银溶液、稀硝酸 | D. | 水、氢氧化钾溶液、稀硝酸? |