题目内容
14.重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.实验室可以采用沉淀转化法.沉淀转化法:25℃时,向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)
【已知25℃时,Ksp(BaSO4)=1.1×10-10,Ksp (BaCO3)=2.6×10-9】
(1)下列说法不正确是BC
A、25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B、25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C、向Na2SO4中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零
(2)25℃时,向BaSO4沉淀中加入饱和Na2CO3溶液,体系达到平衡时,平衡常数K=0.042或4.2×10-2(保留二位有效数字).
分析 (1)A.Ksp只受温度的影响;
B.如满足c(Ba2+)×c(CO32-)>Ksp (BaCO3),则可生成沉淀;
C.没有绝对不溶解的电解质;
(2)BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$.
解答 解:(1)A.Ksp只受温度的影响,加入水,Ksp(BaSO4)不变,故A正确;
B.如满足c(Ba2+)×c(CO32-)>Ksp (BaCO3),则可生成沉淀,故B错误;
C.没有绝对不溶解的电解质,溶液中c(SO42-)不可能为0,故C错误.
故答案为:BC;
(2)BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{1.1×1{0}^{-10}}{2.6×1{0}^{-9}}$=0.042或4.2×10-2.
故答案为:0.042或4.2×10-2.
点评 本题考查了化学平衡常数的计算以及沉淀转化的有关知识,侧重考查学生的分析能力和计算能力的考查,属于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
5.现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
5.高炉炼铁过程中发生的主要反应为$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如表:
请回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<(填>、<或=);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积 F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正)>V(逆) (填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•L-1•min-1CO的平衡转化率=60%.
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<(填>、<或=);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积 F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正)>V(逆) (填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•L-1•min-1CO的平衡转化率=60%.
2.在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0,达到化学平衡.下列有关叙述正确的是( )
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
9.下表列出了3种燃煤烟气脱硫方法的原理.
(1)方法1中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3;(NH4)2SO3+SO2+H2O=2NH4HSO3.下列能提高燃煤烟气中SO2去除速率的措施有A(填字母).
A.适当增大氨水浓度 B.使燃煤烟气与氨水充分接触
C.向氨水中加入少量硫酸 D.把氨水加热至100℃
(2)方法2中主要发生了下列反应:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0KJ•mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4KJ•mol-1
该方法从能量转化的角度,可看作由热能转化为化学能.
(3)方法3可用甲烷燃料电池作为电源,对吸收SO2后的NaHSO3溶液进行电解实验,如图所示.回答下列问题:
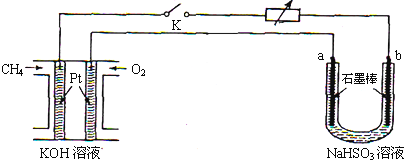
①甲烷燃料电池中,通入CH4(填“CH4”或“O2”)的一极为负极;正极的电极反应式为O2+4e-+2H2O=4OH-;该电池放电后,溶液的碱性会减弱(填“增强”,“减弱”或“不变”).
下列关于该燃料电池的说法中不正确的是B.
A.该燃料电池可把化学能直接转变为电能
B.该燃料电池中化学能100%转变为电能
C.该燃料电池的优点之一是无污染,是一种具有应用前景的绿色电源
②a电极的名称是阳极;闭合开关K后,b电极上发生的反应类型是还原反应.
③若上述甲烷燃料电池中用的是200mL 0.10mol•L-1的KOH溶液,闭合开关K一段时间后,测得U形管中生成了0.02molSO42-.试计算此时燃料电池中KOH的物质的量浓度(假设反应前后溶液的体积不变,列出计算过程).
| 方法1 | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法2 | 用水煤气(主要成分为CO、H2等)将SO2在高温下还原成单质硫 |
| 方法3 | 用Na2SO3溶液吸收SO2转化为NaHSO3,再经电解转化为H2SO4 |
A.适当增大氨水浓度 B.使燃煤烟气与氨水充分接触
C.向氨水中加入少量硫酸 D.把氨水加热至100℃
(2)方法2中主要发生了下列反应:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0KJ•mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4KJ•mol-1
该方法从能量转化的角度,可看作由热能转化为化学能.
(3)方法3可用甲烷燃料电池作为电源,对吸收SO2后的NaHSO3溶液进行电解实验,如图所示.回答下列问题:
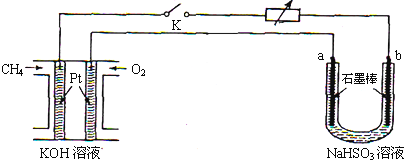
①甲烷燃料电池中,通入CH4(填“CH4”或“O2”)的一极为负极;正极的电极反应式为O2+4e-+2H2O=4OH-;该电池放电后,溶液的碱性会减弱(填“增强”,“减弱”或“不变”).
下列关于该燃料电池的说法中不正确的是B.
A.该燃料电池可把化学能直接转变为电能
B.该燃料电池中化学能100%转变为电能
C.该燃料电池的优点之一是无污染,是一种具有应用前景的绿色电源
②a电极的名称是阳极;闭合开关K后,b电极上发生的反应类型是还原反应.
③若上述甲烷燃料电池中用的是200mL 0.10mol•L-1的KOH溶液,闭合开关K一段时间后,测得U形管中生成了0.02molSO42-.试计算此时燃料电池中KOH的物质的量浓度(假设反应前后溶液的体积不变,列出计算过程).
19.五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请按要求回答下列问题:
(1)X元素名称碳,W的离子结构示意图 ;
;
(2)元素Z位于周期表中的位置是第三周期第VA族;
(3)元素Z可以形成多种单质,请任意写出一种常见单质的名称白磷或红磷;
(4)Y的最高价氧化物的化学式为N2O5;M的最高价氧化物水化物名称为高氯酸;
(5)Z、W、M三种元素中,原子半径最大的是P(填元素符号);这三者与氢元素形成的化合物中,最稳定的是HCl(填:氢化物的化学式),它的电子式为 ;
;
(6)X与M可形成XM4型化合物,是一种常见的溶剂,其中的化学键类型是共价键(填:“离子键”或“共价键”)
(7)W的氧化物有两种A和B,已知在某一定条件下,A和B能同时相互转化.则在该条件下A不能完全转化为B(填:“能”或“不能”)
| X | Y | ||
| Z | W | M |
(1)X元素名称碳,W的离子结构示意图
 ;
;(2)元素Z位于周期表中的位置是第三周期第VA族;
(3)元素Z可以形成多种单质,请任意写出一种常见单质的名称白磷或红磷;
(4)Y的最高价氧化物的化学式为N2O5;M的最高价氧化物水化物名称为高氯酸;
(5)Z、W、M三种元素中,原子半径最大的是P(填元素符号);这三者与氢元素形成的化合物中,最稳定的是HCl(填:氢化物的化学式),它的电子式为
 ;
;(6)X与M可形成XM4型化合物,是一种常见的溶剂,其中的化学键类型是共价键(填:“离子键”或“共价键”)
(7)W的氧化物有两种A和B,已知在某一定条件下,A和B能同时相互转化.则在该条件下A不能完全转化为B(填:“能”或“不能”)
3.等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液完全反应后,溶液中有关离子浓度之间不存在的关系是( )
| A. | c(H+)•c(OH-)=KW | B. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
4.VLFe2(SO4)3溶液中含有a克SO42-的溶液取0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为( )
| A. | $\frac{a}{576V}$ mol•L-1 | B. | $\frac{a}{125}$ mol•L-1 | C. | $\frac{250a}{36V}$mol•L-1 | D. | $\frac{250a}{48V}$mol•L-1 |
