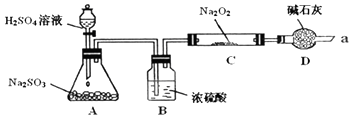
题目内容
13.对可逆应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )| A. | 化学反应速率关系是:2υ正(NH3)=3υ正(H2O) | |
| B. | 达到化学平衡时,4υ正(O2)=5υ逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
分析 反应中反应速率之比等于化学计量数之比,达到平衡时,正逆反应速率相等,增大压强,浓度增大,正逆反应速率都增大,以此解答该题.
解答 解:A.反应速率之比等于化学计量数之比,应为3υ正(NH3)=2υ正(H2O),故A错误;
B.4υ正(O2)=5υ逆(NO),可说明正逆反应速率相等,达到化学平衡状态,故B正确;
C.增大压强,浓度增大,正逆反应速率都增大,故C错误;
D.无论是否达到平衡状态,都存在单位时间内生成x mol NO的同时,消耗x mol NH3,故D错误.
故选B.
点评 本题考查化学平衡状态的判断、化学平衡移动的方向以及影响因素,为高频考点,侧重于双基的考查,注意知识的归纳和整理,难度不大.

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
3.理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放,符合绿色化学的概念.下列反应类型中完全符合要求的是( )
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
1.下列电离方程式正确的是( )
| A. | CaCl2═Ca2++Cl2 | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2OH- | D. | NaHCO3═Na++H++CO32- |
18.下列变化中,需加入氧化剂才能实现的是( )
| A. | N2→NH3 | B. | MgCl2→MgSO4 | C. | Cu→CuO | D. | FeO→Fe |
5.现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
2.在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0,达到化学平衡.下列有关叙述正确的是( )
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |