题目内容
17.在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是( )| A. | 水、氢氧化钾溶液、稀盐酸 | B. | 水、氢氧化钠溶液、稀盐酸? | ||
| C. | 水、硝酸银溶液、稀硝酸 | D. | 水、氢氧化钾溶液、稀硝酸? |
分析 硫酸钡不溶于水,氯化铁能与碱反应生成氢氧化铁沉淀,然后与盐酸反应重新生成氯化铁,以此来解答.
解答 解:三种物质中,硫酸钡不溶于水,故先加水过滤能将硫酸钡分离出来,
要分离氯化铁和氯化钾,需要先将其中的氯化铁转化为氢氧化铁沉淀,此时所选的试剂与氯化铁反应不能生成新的杂质,故可以选用KOH,
然后将生成的氢氧化铁沉淀过滤即可分离得到氯化钾,向生成的氢氧化铁沉淀中加入盐酸即可生成氯化铁,
故选A.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同,且注意不能引入新杂质,难度不大.

练习册系列答案
相关题目
5.现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
12.100mL 6mol/L的硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( ) ①硫酸钠固体,②醋酸钠固体,③硫酸钾溶液,④硝酸钾溶液.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
5.高炉炼铁过程中发生的主要反应为$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如表:
请回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<(填>、<或=);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积 F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正)>V(逆) (填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•L-1•min-1CO的平衡转化率=60%.
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<(填>、<或=);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积 F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正)>V(逆) (填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•L-1•min-1CO的平衡转化率=60%.
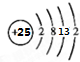 ,其最高正价为+7;是第四周期ⅦB族.
,其最高正价为+7;是第四周期ⅦB族.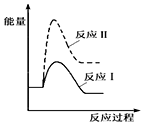
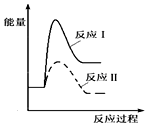
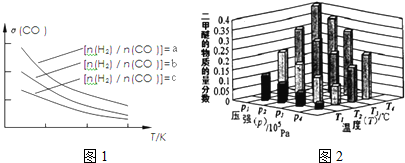
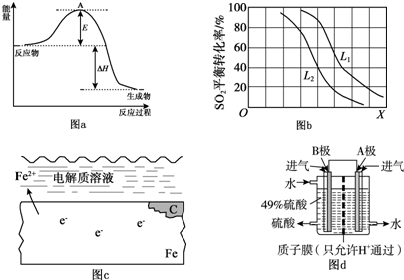
 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
2H2SO4. 2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.
2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.