题目内容
20.按要求写出方程式.(1)氧化镁与稀盐酸反应(写出离子方程式)MgO+2H+=H2O+Cu2+
(2)氢氧化钠溶液和醋酸溶液反应(写出离子方程式)CH3COOH+OH-=CH3COO-+H2O
(3)Fe2(SO4)3(写出电离方程式)Fe2(SO4)3=2Fe3++2SO42-
(4)CO32-+2H+═CO2↑+H2O(写出对应的化学方程式)Na2CO3+2HCl═CO2↑+H2O+2NaCl.
分析 (1)氧化镁与稀盐酸反应生成氯化镁和水;
(2)氢氧化钠溶液和醋酸溶液反应生成醋酸钠和水;
(3)Fe2(SO4)3为强电解质完全电离;
(4)CO32-+2H+═CO2↑+H2O表示可溶性碳酸盐与强酸反应生成二氧化碳和水、可溶性盐;
解答 解:(1)氧化镁与稀盐酸反应生成氯化镁和水,离子方程式:MgO+2H+=H2O+Cu2+;
故答案为:MgO+2H+=H2O+Cu2+;
(2)氢氧化钠溶液和醋酸溶液反应生成醋酸钠和水,离子方程式:CH3COOH+OH-=CH3COO-+H2O;
故答案为:CH3COOH+OH-=CH3COO-+H2O;
(3)Fe2(SO4)3为强电解质完全电离,电离方程式:Fe2(SO4)3=2Fe3++2SO42-;
故答案为:Fe2(SO4)3=2Fe3++2SO42-;
(4)CO32-+2H+═CO2↑+H2O可表示碳酸钠和盐酸的反应,化学方程式:Na2CO3+2HCl═CO2↑+H2O+2NaCl;
故答案为:Na2CO3+2HCl═CO2↑+H2O+2NaCl;
点评 本题考查了离子方程式的书写,明确物质的性质及离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列分离提纯所选用的试剂正确的是( )
| A. | 除去O2中混有的N2:选用灼热的铜网 | |
| B. | 提取碘水中的碘单质:选用有机试剂苯 | |
| C. | 除去CO2中混有的CO:选用适量澄清石灰水 | |
| D. | 除去Mg粉中混有的MgO:选用过量稀盐酸 |
15.将AlCl3溶液和NaAlO2溶液分别蒸干灼烧,对产物的主要成分叙述正确的是( )
| A. | 均为Al(OH)3 | B. | 前者为Al2O3,后者为NaAlO2 | ||
| C. | 均为Al2O3 | D. | 前者为AlCl3,后者为NaAlO2 |
5.现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
12.100mL 6mol/L的硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( ) ①硫酸钠固体,②醋酸钠固体,③硫酸钾溶液,④硝酸钾溶液.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
9.下表列出了3种燃煤烟气脱硫方法的原理.
(1)方法1中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3;(NH4)2SO3+SO2+H2O=2NH4HSO3.下列能提高燃煤烟气中SO2去除速率的措施有A(填字母).
A.适当增大氨水浓度 B.使燃煤烟气与氨水充分接触
C.向氨水中加入少量硫酸 D.把氨水加热至100℃
(2)方法2中主要发生了下列反应:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0KJ•mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4KJ•mol-1
该方法从能量转化的角度,可看作由热能转化为化学能.
(3)方法3可用甲烷燃料电池作为电源,对吸收SO2后的NaHSO3溶液进行电解实验,如图所示.回答下列问题:
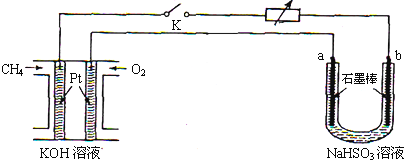
①甲烷燃料电池中,通入CH4(填“CH4”或“O2”)的一极为负极;正极的电极反应式为O2+4e-+2H2O=4OH-;该电池放电后,溶液的碱性会减弱(填“增强”,“减弱”或“不变”).
下列关于该燃料电池的说法中不正确的是B.
A.该燃料电池可把化学能直接转变为电能
B.该燃料电池中化学能100%转变为电能
C.该燃料电池的优点之一是无污染,是一种具有应用前景的绿色电源
②a电极的名称是阳极;闭合开关K后,b电极上发生的反应类型是还原反应.
③若上述甲烷燃料电池中用的是200mL 0.10mol•L-1的KOH溶液,闭合开关K一段时间后,测得U形管中生成了0.02molSO42-.试计算此时燃料电池中KOH的物质的量浓度(假设反应前后溶液的体积不变,列出计算过程).
| 方法1 | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法2 | 用水煤气(主要成分为CO、H2等)将SO2在高温下还原成单质硫 |
| 方法3 | 用Na2SO3溶液吸收SO2转化为NaHSO3,再经电解转化为H2SO4 |
A.适当增大氨水浓度 B.使燃煤烟气与氨水充分接触
C.向氨水中加入少量硫酸 D.把氨水加热至100℃
(2)方法2中主要发生了下列反应:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0KJ•mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4KJ•mol-1
该方法从能量转化的角度,可看作由热能转化为化学能.
(3)方法3可用甲烷燃料电池作为电源,对吸收SO2后的NaHSO3溶液进行电解实验,如图所示.回答下列问题:
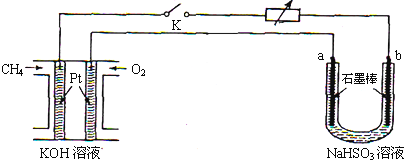
①甲烷燃料电池中,通入CH4(填“CH4”或“O2”)的一极为负极;正极的电极反应式为O2+4e-+2H2O=4OH-;该电池放电后,溶液的碱性会减弱(填“增强”,“减弱”或“不变”).
下列关于该燃料电池的说法中不正确的是B.
A.该燃料电池可把化学能直接转变为电能
B.该燃料电池中化学能100%转变为电能
C.该燃料电池的优点之一是无污染,是一种具有应用前景的绿色电源
②a电极的名称是阳极;闭合开关K后,b电极上发生的反应类型是还原反应.
③若上述甲烷燃料电池中用的是200mL 0.10mol•L-1的KOH溶液,闭合开关K一段时间后,测得U形管中生成了0.02molSO42-.试计算此时燃料电池中KOH的物质的量浓度(假设反应前后溶液的体积不变,列出计算过程).




 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
2H2SO4. 2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.
2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.